Температура
Взаимосвязь температуры и плотности газа
Тепловое движение частиц газа зависит напрямую от его температуры. При повышении температуры газовые молекулы приобретают большую кинетическую энергию, что приводит к увеличению их скорости и частоты столкновений. В результате газ расширяется и его плотность становится ниже.
Измерение температуры в отношении плотности газов
Для определения влияния температуры на относительную плотность газа по воздуху необходимо провести эксперименты и измерения. Используя специальные устройства, такие как термометр и барометр, можно определить как температуру, так и давление газа, что позволит получить более точные данные о его плотности.
Взаимосвязь с другими показателями
Относительная плотность в химии является важным параметром, который имеет связь с другими показателями. Рассмотрим несколько примеров:
-
Плотность вещества – относительная плотность является мерой плотности вещества. Она определяется как отношение массы вещества к его объему. Измерение относительной плотности позволяет получить информацию о плотности вещества и его свойствах.
-
Температура вещества – при изменении температуры, плотность вещества также может изменяться. Относительная плотность может помочь установить взаимосвязь между температурой и плотностью вещества. Данная информация важна при проведении экспериментов и исследований в химии.
-
Концентрация растворов – относительная плотность может использоваться для определения концентрации раствора. Путем измерения плотности растворов различной концентрации можно установить зависимость между относительной плотностью и концентрацией.
-
Количественный анализ вещества – при проведении количественного анализа, относительная плотность может использоваться для определения содержания определенного вещества в смеси. Методы определения относительной плотности широко применяются в аналитической химии для определения состава смесей.
Таким образом, относительная плотность в химии имеет взаимосвязь с другими показателями и играет важную роль при определении свойств веществ и проведении анализов.
Объемные отношения газов при химических реакциях
Вещество из жидкого или твердого переходит в газообразное агрегатное состояние при нагреве, примерами таких процессов являются:
- кипение жидкостей;
- возгонка твердых веществ (переход из твердого состояния сразу в газообразное).
В связи с тем, что расстояние между молекулами газов существенно превышает размеры самих молекул, объем, занимаемый газообразным веществом, является объемом свободного пространства между молекулами газа, перемещающимися хаотично. Величина этого пространства зависит от условий, при которых находится газ:
- температура;
- давление.
Данная характеристика практически равна для всех газов. При этом объемом, который занимают сами молекулы, допустимо пренебречь. Вывод из вышесказанного сформулирован в законе Авогадро.
Молярный объем газа определяют как отношение объема газа к его количеству:
Величина Vm определяется следующими факторами:
- температура;
- давление.
В качестве примера можно рассмотреть нагрев газов. В процессе повышения температуры происходит расширение газообразного вещества. Таким образом, при нагревании увеличивается молярный объем газа. По этой причине сравнение параметров каких-либо смесей газообразных веществ следует выполнять при одинаковых условиях, то есть одинаковой температуре и давлении. Эталонными являются нормальные условия:
Данное утверждение можно доказать практическим примером. Допустим, что имеются две порции неодинаковых газообразных веществ. Можно определить плотности этих газов:
В результате деления плотности первого газа на плотность второго получим выражение:
Относительная плотность газа D является безразмерной величиной. Зная эту характеристику и молярную массу одного газа, достаточно просто вычислить молярную массу другого газа:
При решении задач по химии нередко встречаются заданные относительные плотности неизвестного газа по азоту, кислороду и другим газам. В такой ситуации для определения молярной массы неизвестного газа нужно найти произведение относительной плотности и молярной массы соответственно азота (28 г/моль), кислорода (32 г/моль) и т. д.
Закон Авогадро нашел широкое применение в химических расчетах. В связи с тем, что в случае газов объемы пропорциональны количествам (моль) веществ, коэффициенты в уравнении реакции между газообразными веществами, которые отражают численное соотношение реагирующих веществ, пропорциональны объемам взаимодействующих газов. Таким образом, объемы требуется измерять в одинаковых условиях.
В качестве примера можно рассмотреть пару колб, объем которых равен . Одну емкость наполнили азотом, а другую — метаном. В колбах поддерживаются одинаковые значения температуры и давления. При смешивании содержимого данных колб получится смесь, которая в аналогичных условиях занимает объем
Состав смеси газов в распространенных случаях записывают в объемных долях. Для обозначения объемной доли принято использовать греческую букву . Параметр определяют, как отношение объема данного газа к объему смеси.
Применимо к рассмотренному ранее примеру, объемная доля азота в полученной смеси составит:
Значение и применение в практике
Относительная плотность в химии является важной характеристикой вещества и имеет широкое применение в практике. Она позволяет определить, насколько данное вещество плотное по сравнению с водой
Значение относительной плотности вещества может использоваться для определения его чистоты. Если относительная плотность известного образца отличается от значения плотности, указанной в литературе, это может указывать на наличие примесей в веществе.
Относительная плотность также используется для определения концентрации растворов. С помощью соотношения относительных плотностей раствора и растворителя можно рассчитать процентное содержание вещества в растворе
Это важно, например, при определении концентрации лекарственных препаратов или химических реагентов
Для многих технических задач необходимо знать относительную плотность материалов. Например, инженеры используют ее при проектировании зданий и сооружений, чтобы определить необходимую прочность материалов или при выборе материала для определенной задачи. В промышленности относительная плотность также играет важную роль при разработке новых материалов или контроле качества продукции.
Определение относительной плотности может проводиться с использованием различных методов, включая гидростатический метод, ареометрию или пирометрию. Каждый метод имеет свои преимущества и ограничения, и выбор метода зависит от характеристик исследуемого материала.
В целом, относительная плотность является важной характеристикой вещества и имеет множество практических применений в химии, инженерии и промышленности
Таблицы плотности некоторых тел и веществ
Например, плотность воды составляет $1000 \frac{кг}{м^3}$, льда — $900 \frac{кг}{м^3}$, водяного пара — $0.590 \frac{кг}{м^3}$ (рисунок 5).
Рисунок 5. Плотности одного вещества в разных агрегатных состояниях
{"questions":,"answer":}}}]}
Плотности различных твердых тел
| Твердое тело | $\rho, \frac{кг}{м^3}$ | $\rho, \frac{г}{см^3}$ | Твердое тело | $\rho, \frac{кг}{м^3}$ | $\rho, \frac{г}{см^3}$ |
|---|---|---|---|---|---|
| Осмий | 22 600 | 22,6 | Мрамор | 2700 | 2,7 |
| Иридий | 22 400 | 22,4 | Стекло | 2500 | 2,5 |
| Платина | 21 500 | 21,5 | Фарфор | 2300 | 2,3 |
| Золото | 19 300 | 19,3 | Бетон | 2300 | 2,3 |
| Свинец | 11 300 | 11,3 | Кирпич | 1800 | 1,8 |
| Серебро | 10 500 | 10,5 | Сахар | 1600 | 1,6 |
| Медь | 8900 | 8,9 | Оргстекло | 1200 | 1,2 |
| Латунь | 8500 | 8,5 | Капрон | 1100 | 1,1 |
| Сталь, железо | 7800 | 7,8 | Полиэтилен | 920 | 0,92 |
| Олово | 7300 | 7,3 | Парафин | 900 | 0,90 |
| Цинк | 7100 | 7,1 | Лед | 900 | 0,90 |
| Чугун | 7000 | 7,0 | Дуб сухой | 700 | 0,70 |
| Корунд | 4000 | 4,0 | Сосна сухая | 400 | 0,40 |
| Алюминий | 2700 | 2,7 | Пробка | 240 | 0,24 |
Таблица 1. Плотности твердых тел
{"questions":,"answer":}}}]}
Плотности различных жидкостей
| Жидкость | $\rho, \frac{кг}{м^3}$ | $\rho, \frac{г}{см^3}$ | Жидкость | $\rho, \frac{кг}{м^3}$ | $\rho, \frac{г}{см^3}$ |
|---|---|---|---|---|---|
| Ртуть | 13 600 | 13,60 | Керосин | 800 | 0,80 |
| Серная кислота | 1800 | 1,80 | Спирт | 800 | 0,80 |
| Мед | 1350 | 1,35 | Нефть | 800 | 0,80 |
| Вода морская | 1030 | 1,03 | Ацетон | 790 | 0,79 |
| Молоко цельное | 1030 | 1,03 | Эфир | 710 | 0,41 |
| Вода чистая | 1000 | 1,00 | Бензин | 710 | 0,71 |
| Масло подсолнечное | 930 | 0,93 | Жидкое олово (при $400^{\circ}$) | 6800 | 6,80 |
| Масло машинное | 900 | 0,90 | Жидкий воздух (при $-194^{\circ}$) | 860 | 0,86 |
Таблица 2. Плотности жидкостей
{"questions":,"answer":}}}]}
Плотности различных газов
| Газ | $\rho, \frac{кг}{м^3}$ | $\rho, \frac{г}{см^3}$ | Газ | $\rho, \frac{кг}{м^3}$ | $\rho, \frac{г}{см^3}$ |
|---|---|---|---|---|---|
| Хлор | 3,210 | 0,00321 | Угарный газ | 1,250 | 0,00125 |
| Углекислый газ | 1,980 | 0,00198 | Природный газ | 0,800 | 0,0008 |
| Кислород | 1,430 | 0,00143 | Водяной пар (при $100^{\circ}$) | 0,590 | 0,00059 |
| Воздух (при $0^{\circ}C$ | 1,290 | 0,00129 | Гелий | 0,180 | 0,00018 |
| Азот | 1,250 | 0,00125 | Водород | 0,090 | 0,00009 |
Таблица 3. Плотности газов
{"questions":[{"content":"Чему равна плотность азота?<br />Ответ: $\\rho =$`input-21` $\\frac{кг}{м^3}$.","widgets":{"input-21":{"type":"input","inline":1,"answer":}}}]}
Моль. Закон Авогадро. Молярный объем газа
Моль (n) — кол-во вещества, содержащее столько структурных единиц (молекул, атомов, ионов и др.), сколько атомов содержится в 12 г (0,012 кг) изотопа углерода 12С 1моль вещества содержит 6,02*1023 структурных единиц (число Авогадро , NА)
Формулы, отражающие взаимосвязь объема вещества, его массы и молекулярной массы.
Где m-масса,M-молярная масса, V- объем.
4. Закон Авогадро. Установлен итальянским физиком Авогадро в 1811 г. Одинаковые объемы любых газов, отобранные при одной температуре и одинаковом давлении, содержат одно и тоже число молекул.
Таким образом, можно сформулировать понятие количества вещества: 1 моль вещества содержит число частиц, равное 6,02*1023 (называемое постоянной Авогадро)
Следствием этого закона является то, что 1 моль любого газа занимает при нормальных условиях (Р0 =101,3кПа и Т0=298К) объём, равный 22,4л.
5. Закон Бойля-Мариотта
При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
PV = const.
6. Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре:
V/T = const.
7. Зависимость между объемом газа, давлением и температурой можно выразить объединенным законом Бойля-Мариотта и Гей-Люссака, которым пользуются для приведения объемов газа от одних условий к другим :
Обратите внимание
P0, V0 ,T0-давление объема и температуры при нормальных условиях: P0=760 мм рт. ст. или 101,3 кПа ; T0=273 К (00С)
8. Независимая оценка значения молекулярноймассы М может быть выполнена с использованием так называемого уравнения состояния идеального газа или уравнения Клапейрона-Менделеева
pV=(m/M)*RT=vRT.(1.1)
где р — давление газа в замкнутой системе, V — объем системы, т — масса газа, Т — абсолютная температура, R —универсальная газовая постоянная.
Отметим, что значение постоянной R может быть получено подстановкой величин, характеризующих один моль газа при н.у., в уравнение (1.1):
r = (р V)/( Т)=(101,325кПа 22.4л)/(1 моль 273К)=8.31Дж/моль.К)
Примеры решения задач
Пример 1. Приведение объема газа к нормальным условиям.
Решение.
Для приведения объема газа к нормальным условиям пользуются общей формулой, объединяющей законы Бойля-Мариотта и Гей-Люссака:
pV/T = p0V0/T0.
Объем газа (н.у.) равен, где Т0 = 273 К; р0 = 1,013×105 Па; Т = 273 + 50 = 323 К;
м3 = 0,32×10-3 м3.
При (н.у.) газ занимает объем, равный 0,32×10-3 м3.
Пример 2. Вычисление относительной плотности газа по его молекулярной массе.
Вычислите плотность этана С2Н6 по водороду и воздуху.
Решение.
Из закона Авогадро вытекает, что относительная плотность одного газа по другому равна отношению молекулярных масс (Мч) этих газов, т.е. D=М1/М2. Если М1 С2Н6 = 30, М2 Н2 = 2, средняя молекулярная масса воздуха равна 29, то относительная плотность этана по водороду равна DН2 = 30/2 =15.
Относительная плотность этана по воздуху: Dвозд = 30/29 = 1,03, т.е. этан в 15 раз тяжелее водорода и в 1,03 раза тяжелее воздуха.
Пример 3. Определение средней молекулярной массы смеси газов по относительной плотности.
Вычислите среднюю молекулярную массу смеси газов, состоящей из 80 % метана и 20 % кислорода (по объему), используя значения относительной плотности этих газов по водороду.
Решение.
Часто вычисления производят по правилу смешения, которое заключается в том, что отношение объемов газов в двухкомпонентной газовой смеси обратно пропорционально разностям между плотностью смеси и плотностями газов, составляющих эту смесь. Обозначим относительную плотность газовой смеси по водороду через DН2. она будет больше плотности метана, но меньше плотности кислорода:
;;
80DН2 – 640 = 320 – 20DН2 ; DН2 = 9,6.
Плотность этой смеси газов по водороду равна 9,6. средняя молекулярная масса газовой смеси МН2 = 2DН2 = 9,6×2 = 19,2.
Пример 4. Вычисление молярной массы газа.
Важно
Масса0,327×10-3 м3 газа при 130С и давлении 1,040×105 Па равна 0,828×10-3 кг. Вычислите молярную массу газа.
Решение.
Вычислить молярную массу газа можно, используя уравнение Менделеева-Клапейрона:
,
где m – масса газа; М – молярная масса газа; R – молярная (универсальная) газовая постоянная, значение которой определяется принятыми единицами измерения.
Если давление измерять в Па, а объем в м3, то R=8,3144×103 Дж/(кмоль×К).
Определение плотности воздуха ^
Не так давно сведения о плотности воздуха получали косвенно за счет наблюдений за полярными сияниями, распространением радиоволн, метеорами. С момента появления искусственных спутников Земли плотность воздуха начали вычислять благодаря данным, полученным от их торможения.
Еще один метод заключается в наблюдениях за расплыванием искусственных облаков из паров натрия, создаваемых метеорологическими ракетами. В Европе плотность воздуха у поверхности Земли составляет 1,258 кг/м3, на высоте пяти км — 0,735, на высоте двадцати км — 0,087, на высоте сорока км — 0,004 кг/м3.
Различают два вида плотности воздуха: массовая и весовая (удельный вес).
Определение и значение

Относительная плотность по азоту имеет важное значение в различных областях науки и техники. Например, она используется для определения плотности жидкостей и газов, а также для калибровки металлических и стеклянных изделий
Медицинская промышленность использует относительную плотность по азоту для контроля качества лекарственных препаратов и диагностических средств.
Измерение относительной плотности по азоту происходит с использованием пикнометра — специального стеклянного сосуда с маленьким горлышком. Пикнометр заполняется азотом и весится. Затем в него помещается исследуемое вещество, пикнометр снова взвешивается, и разность массы азота и массы азота с веществом дает плотность исследуемого вещества по отношению к плотности азота.
Количество вещества
Как говорил Д. И. Менделеева «Наука начинается, когда начинают измерять». Но как можно измерить вещество? В порциях, штуках?
 (Источник)
(Источник)
Порцию считаем в граммах, в штуках количество. Например, в магазине вы не покупаете 1000 штук зёрен риса или пшена, а просите взвесить определённый вес (1 кг, 10 кг) или берёте с полки уже расфасованный. Либо необходимо взять молочные продукты, мы берём пакеты объёмом 0,5 л или 1 л. Одинаковая по весу порция содержит примерно одинаковое количество зёрен. Этот принцип применяется и в химии. Порция атомов или молекул называется количеством вещества.
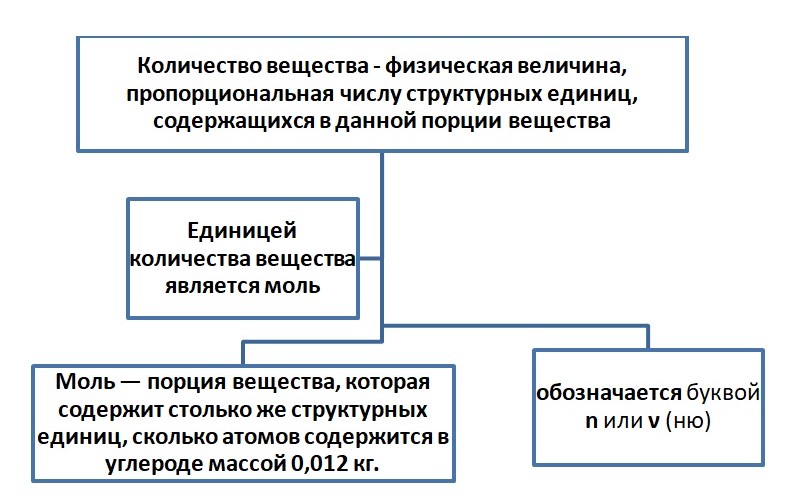
Размерность «моль» не сокращается, т. е. в отличие от литров (л), миллилитров (мл), сантиметров (см) на письме и при чтении указываем 4 моль, 5 сантиметров (5 см).
Если учесть, что атом Углерода имеет вес, (1.994 ∙ 10−23г), то не составит труда узнать, сколько атомов будет содержаться в порции 12 г.
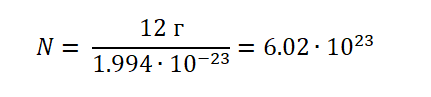
Можно сделать вывод, что 1 моль любого вещества (воды, углекислого газа, поваренной соли, серной кислоты и т. д) будет содержать 6,02∙1023 структурных единиц.
Это число является одним из важнейших не только в химии, но и в физике – оно носит название постоянная Авогадро (NA).
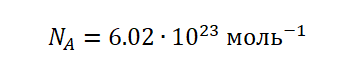
С этого следует, что NA показывает, сколько частиц содержится в 1 моль вещества, в этом и состоит её физический смысл.
Но что делать, если, к примеру, вещество дано в количестве 2 моль, 10 моль или 0.5 моль. Приведём сравнение с математикой, в одной корзине содержится 5 яблок, сколько яблок содержится в трёх таких корзинах. Ответ будет 15 яблок, полученный путём умножения 5 ∙ 3 = 15. Аналогично и с количеством молекул. Чтобы найти эту величину, используем формулу:
N = n * NA
Где N – количество структурных единиц.
Важно: не путать эти две величины, оба эти параметра показывают количество, но:
N — количество структурных единиц,
n — количество вещества (моль)
Рассмотрим подробно данные выводы.
Задача 3. Какое количество вещества составляют 2.709 ∙ 1024 молекул хлора? 
Так, в корзине может содержаться 5 яблок, 10 груш и 8 слив, и наша задача посчитать: «Сколько содержится фруктов?» А сколько будет содержаться в 8 таких корзинах яблок? Эти примеры нам знакомы ещё с первого класса. Молекула может состоять из нескольких атомов, и иногда необходимо точно знать, сколько их штук.
Молярная масса
Помните вопрос с первого класса: «Что тяжелее 1 кг золота и 1 кг пуха?». Ответ был: одинаковый вес, ведь и золото, и пух весят по 1 кг. Но если спросить, что тяжелее 1 моль метана или 1 моль фруктозы? Чтобы дать ответ на данный вопрос, введём следующее понятие.
Масса 1 моля любого вещества называется молярной массой (размерность г/моль, обозначение М). Не стоит путать с Mr, хоть они численно равны, но отличаются в следующем. Молярная имеет размерность (г/моль).
Связь количества вещества и массы выражается в следующем виде:
m = n * M
Возьмём для примера метан, фруктозу и хлороводород количеством вещества 1 моль.
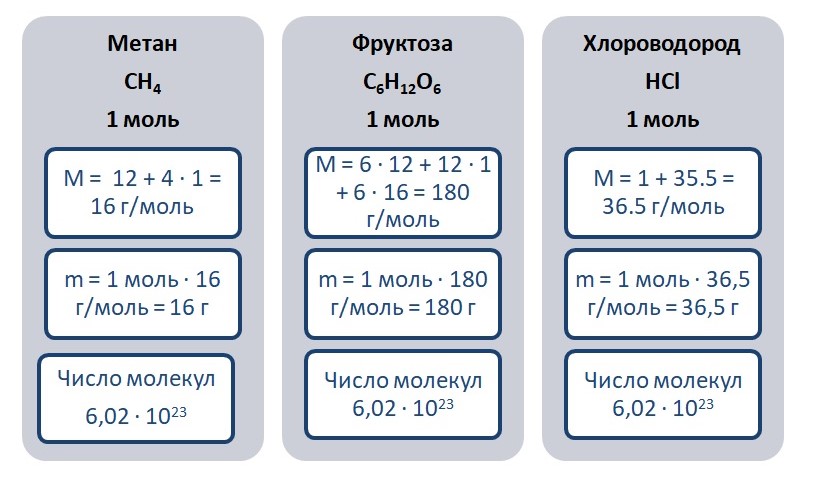
С расчётов делаем вывод, что масса 1 моль фруктозы тяжелее, в её состав входит большее количество атомов.
Молярный объём газов
Вещества в газообразном состоянии, в отличие от жидких и твёрдых веществ, при одинаковых условиях (одинаковые давление и температура) будут занимать одинаковый объём.
Допустим, что имеем газ количеством вещества 1 моль. Как известно 1 моль любого соединения содержит 6,02 ∙ 1023 структурных единиц.
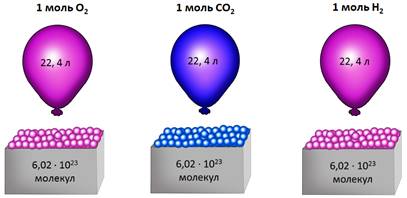 (Источник)
(Источник)
Опытным путём установлено, что 1 моль любого газа при н. у. занимает объём равный 22,4 л/моль.
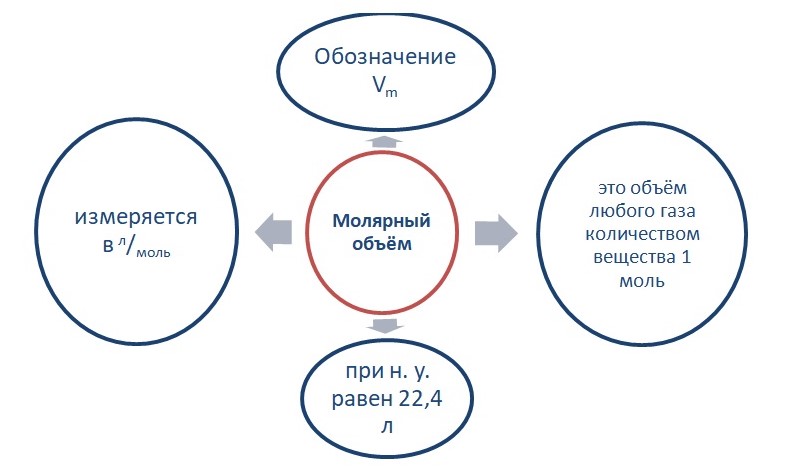
Связь количества вещества и объёма выражается в следующем виде:
V = n * Vm
Задача 6. Какой объём (н. у.) будет занимать 0,25 моль ацетилена (С2Н2)?

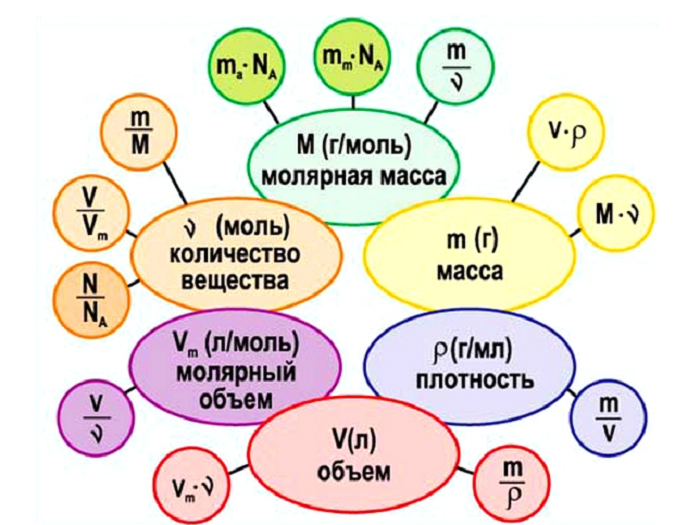
Как можно увидеть, количество вещества связывает три величины:
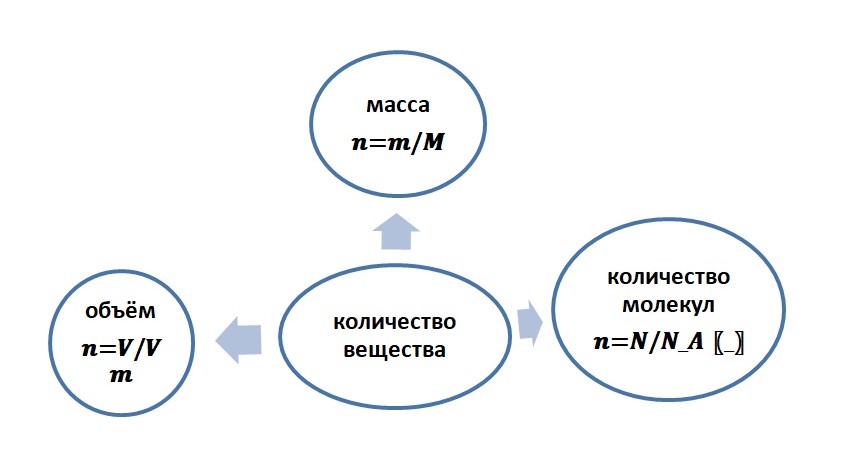
Приравняв между собой три выражения, а именно:
Получаем следующую взаимосвязь
 (Источник)
(Источник)
Влияние на свойства вещества
Относительная плотность вещества является одним из основных показателей его свойств.
Вещество с большей относительной плотностью обычно более плотное, тяжелое и компактное. Такое вещество обладает большей массой при одинаковом объеме по сравнению с веществом с меньшей относительной плотностью.
Относительная плотность также может указывать на прочность вещества. Обычно материалы с большей относительной плотностью также обладают большей прочностью и устойчивостью к деформациям.
Однако, относительная плотность не является единственным показателем, определяющим свойства вещества. Она может варьироваться в зависимости от условий окружающей среды, температуры и давления.
Например, вода имеет относительную плотность 1 при 4 °C, что делает ее удобной для использования в качестве стандарта для измерения относительной плотности других веществ. Относительная плотность воды также изменяется с изменением температуры и солености воды.
Изменение относительной плотности может влиять на такие свойства вещества, как плавучесть и растворимость. Вещество с меньшей относительной плотностью, чем жидкость, в которую оно погружено, будет плавать на поверхности жидкости. Вещество с большей относительной плотностью будет тонуть.
Также относительная плотность может влиять на растворимость вещества в других веществах. Обычно вещества с более близкими относительными плотностями легче смешиваются и растворяются друг в друге. Материалы с большим различием в относительной плотности могут быть несовместимыми и не смешиваться.
| Свойство | Влияние относительной плотности |
|---|---|
| Плотность | Чем больше относительная плотность, тем плотнее вещество. |
| Прочность | Материалы с большей относительной плотностью чаще обладают большей прочностью. |
| Плавучесть | Вещество с меньшей относительной плотностью будет плавать на поверхности жидкости с большей плотностью. |
| Растворимость | Вещества с более близкими относительными плотностями легче смешиваются и растворяются друг в друге. |




























