Электронейтральный атом: общее представление
Количество электронов в атоме определяется его атомным номером, который также указывает на количество протонов в ядре атома. Например, у атома кислорода (O) атомный номер равен 8. Это означает, что у кислородного атома в нейтральном состоянии также должно быть 8 электронов, чтобы количество электронов совпадало с количеством протонов.
Возможно возникновение ионов, когда число электронов в атоме не равно числу протонов. Если атом получает или теряет один или несколько электронов, он становится ионом с положительным или отрицательным зарядом. Однако в обычных условиях атомы большинства химических элементов остаются электронейтральными.
Электронейтральные атомы играют ключевую роль в химических реакциях. Они образуют связи с другими атомами, обмениваются электронами и образуют молекулы. Нейтральность атомов позволяет им притягиваться и взаимодействовать между собой, что формирует различные соединения и структуры веществ.
Примеры электронейтральных атомов: атом водорода (H), атом углерода (C), атом азота (N), атом кислорода (O), атом фтора (F) и многих других элементов из периодической системы.
История открытия и строение
Понятия атома было известно еще в Древней Греции. Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Не известно, рассказали тогдашним философам об атомах инопланетяне, или они додумались сами, но экспериментально подтвердить данную теорию химики смогли много позже – только в семнадцатом веке, когда Европа выплыла из пучины инквизиции и средневековья.
Долгое время господствующим представлением о строении атома было представление о нем как о неделимой частице. То, что атом все-таки можно разделить, выяснилось только в начале двадцатого века. Резерфорд, благодаря своему знаменитому опыту с отклонением альфа-частиц, узнал, что атом состоит из ядра, вокруг которого вращаются электроны. Была принята планетарная модель атома, в соответствии с которой электроны вращаются вокруг ядра, как планеты нашей Солнечной системы вокруг звезды.
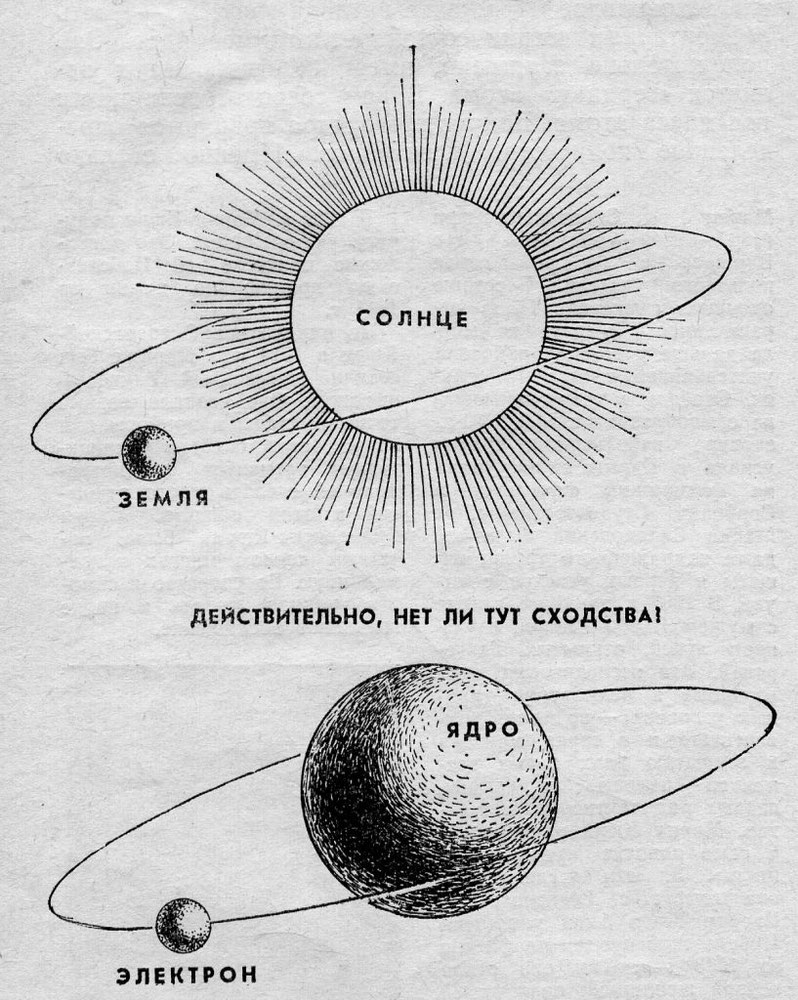 Планетарная модель
Планетарная модель
Современные представления о строении атома продвинулись далеко. Ядро атома, в свою очередь, состоит субатомных частиц, или нуклонов – протонов и нейтронов. Именно нуклоны составляют основную массу атома. При этом протоны и нейтроны также не являются неделимыми частицами, и состоят из фундаментальных частиц — кварков.
Ядро атома имеет положительный электрический заряд, а электроны, вращающиеся по орбите – отрицательный. Таким образом, атом электрически нейтрален.
Ниже приведем элементарную схему строения атома углерода.
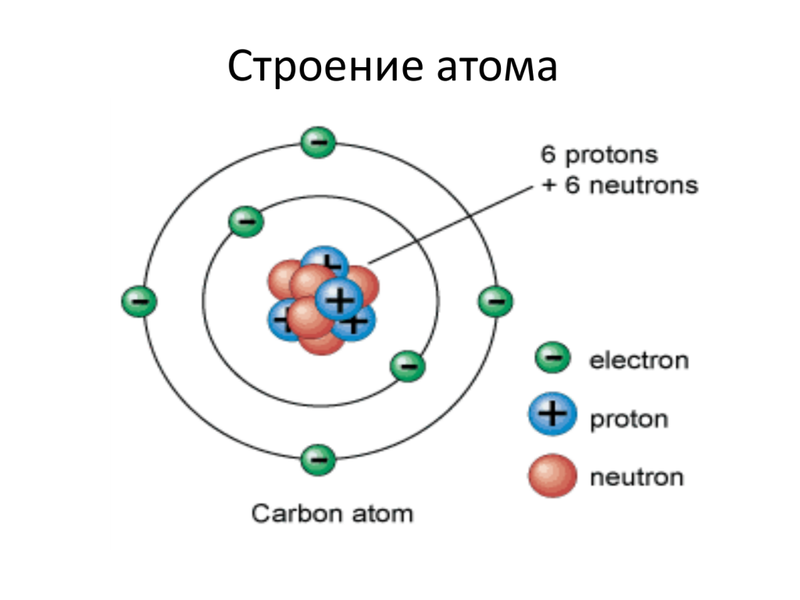 Схема строения атома
Схема строения атома
Откуда взялись атомы?
Как известно, сейчас различные атомы сгруппированы в таблицу Менделеева. В ней насчитывается 118 (а если с предсказанными, но еще не открытыми элементами — 126) элементов, не считая изотопов. Но так было далеко не всегда.
В самом начале формирования Вселенной никаких атомов не было и подавно, существовали лишь элементарные частицы, под воздействием огромных температур взаимодействующие между собой. Как сказал бы поэт, это был настоящий апофеоз частиц. В первые три минуты существования Вселенной, из-за понижения температуры и совпадения еще целой кучи факторов, запустился процесс первичного нуклеосинтеза, когда из элементарных частиц появились первые элементы: водород, гелий, литий и дейтерий (тяжелый водород). Именно из этих элементов образовались первые звезды, в недрах которых проходили термоядерные реакции, в результате которых водород и гелий «сгорали», образуя более тяжелые элементы. Если звезда была достаточно большой, то свою жизнь она заканчивала так называемым взрывом «сверхновой», в результате которого атомы выбрасывались в окружающее пространство. Так и получилась вся таблица Менделеева.
 Вселенная
Вселенная
Валентные и неспаренные электроны
Валентные электроны — электроны, способные участвовать в образовании химических связей.
Представим вкусный большой многослойный ягодный торт. Каждый слой — своего рода уровень. На слоях располагаются ягоды, они же электроны. Но самые вкусные (валентные) всегда располагают сверху на торте. То есть валентные электроны могут быть как на внешнем (в качестве украшения торта), так и на предвнешнем (верхнем бисквитном слое) энергетическом уровне.
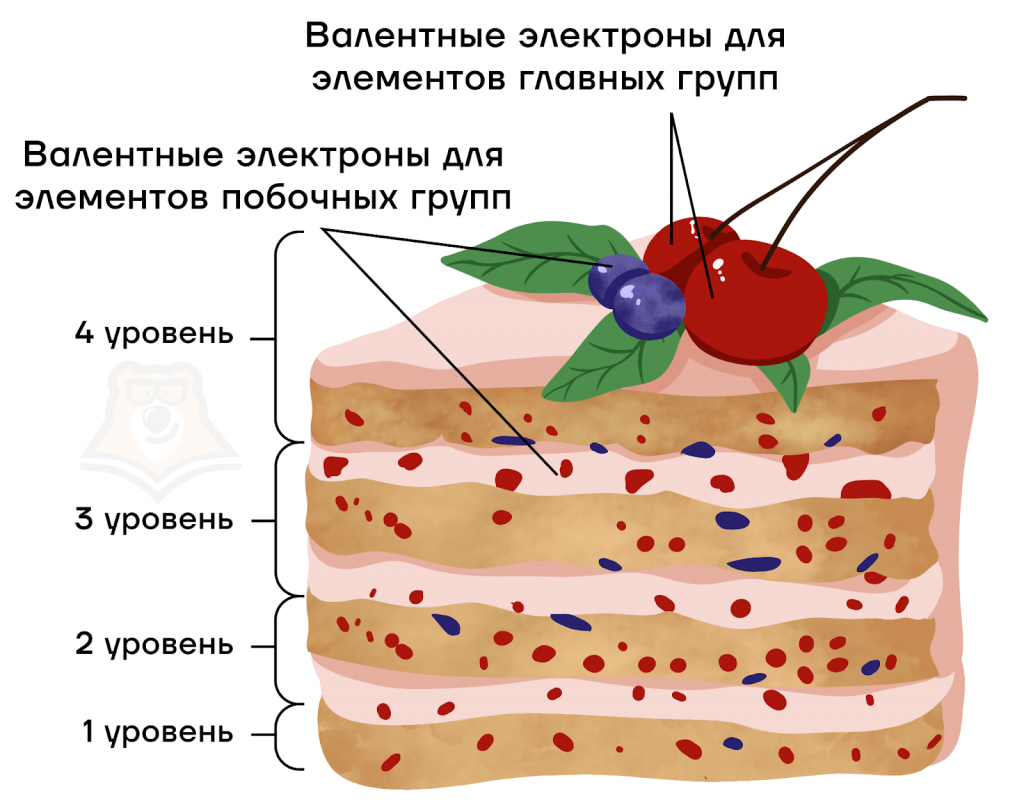
Поэтому важно научиться определять количество валентных электронов для различных элементов:
- для элементов главных подгрупп — это все электроны внешнего уровня;
- для элементов побочных подгрупп — это электроны внешнего слоя и предвнешнего d-подуровня.
Среди валентных электронов есть как спаренные электроны, так и неспаренные.
Неспаренными называют электроны, которые находятся поодиночке на орбитали атома, соответственно, спаренные — всегда вдвоем.
Например, у атома водорода один неспаренный электрон на внешнем энергетическом уровне, а вот у атома гелия неспаренных электронов уже нет, но так как оба они находятся на внешнем (и в данном случае единственном) энергетическом уровне, они будут валентными.

Запоминалка: существует последовательность чисел, которая позволяет определить количество неспаренных электронов для атомов главных подгрупп: 1-0-1-2-3-2-1-0.
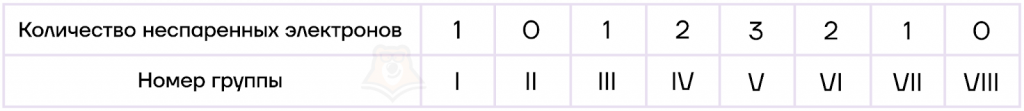
Таким образом, все неспаренные электроны являются валентными, но не все валентные электроны должны быть неспаренными.
Разберем еще один пример задания №1 ЕГЭ по химии.Задание. Определите, атомы каких из указанных в ряду элементов имеют одинаковое количество неспаренных электронов.1) Li 2) Ca 3) N 4) Ne 5) HРешение. Чтобы решить задание, нужно вспомнить последовательность чисел, которая позволяет определить количество неспаренных электроновдля атомов главных подгрупп: 1-0-1-2-3-2-1-0.Li — элемент IA группы (1-0-1-2-3-2-1-0), значит, у него один неспаренный электрон.Ca — элемент IIA группы (1—1-2-3-2-1-0), значит, у него нет неспаренных электронов.N — элемент VA группы (1-0-1-2-3-2-1-0), значит, у него три неспаренных электрона.Ne — элемент VIIIA группы (1-0-1-2-3-2-1-), значит, у него нет неспаренных электронов.H — элемент IA группы (1-0-1-2-3-2-1-0), значит, у него один неспаренный электрон.Ответ: 15
Строение атома — это тема, с которой всегда начинают познание химии, потому что приступать к изучению химических свойств веществ можно только с пониманием поведения элементарных частиц на атомарном уровне. Изучить тему подробнее и разобрать все ее тонкости поможет статья «Особенности строения электронных оболочек атомов переходных элементов».
химические характеристики
В химии атомы являются фундаментальными единицами, которые обычно сохраняют свои первоначальные свойства в каждой реакции. Они не разрушаются и не создаются, они просто устроены по-разному с разными связями между собой.
Атомы слипаются, образуя молекулы и другие виды материалов. Связи, возникающие в результате химических реакций, имеют определенный состав, отличающий различные химические элементы. Это те элементы, которые появляются в периодической таблице элементов.
Каждый из этих элементов имеет много протонов в ядре. Это число называется атомным номером и обозначается буквой Z. Все атомы с одинаковым числом протонов принадлежат к одному и тому же элементу и обладают одинаковыми химическими свойствами, даже если они являются разными химическими элементами.
Кроме того, находим массовое число, обозначаемое буквой А. Это число относится к числу нуклонов, присутствующих в атоме. Другой тип атома, который мы можем найти и о котором мы знаем лучше всего, — это изотоп. Эти атомы имеют одинаковое количество протонов, но разное количество нейтронов. Они имеют одинаковые химические свойства, хотя их физические свойства отличаются друг от друга.
Как мы отмечали ранее, изотопы очень важны. И они жизненно важны для ядерной энергетики, потому что обогащение урана включает преобразование одного изотопа урана в другой с более нестабильной химической структурой, что позволяет нам иметь цепную реакцию.
Ионизация и ионы
Ионизация — процесс, при котором из атома выбивается или добавляется один или несколько электронов, что приводит к образованию иона.
Ион – это заряженная частица, образовавшаяся в результате ионизации атома. Ионы могут быть положительными или отрицательными в зависимости от того, сколько электронов было удалено или добавлено из атома.
Положительные ионы называют катионами, а отрицательные – анионами. Катионы содержат меньше электронов, чем нейтральный атом, поэтому имеют положительный заряд. Например, натрий в виде иона имеет заряд +1, а железо +2. Анионы содержат больше электронов, чем нейтральный атом, поэтому имеют отрицательный заряд. Например, хлор в виде иона имеет заряд -1, а кислород -2.
Образование ионов является важным процессом в химии. Ионы могут переносить электрический заряд, участвовать в химических реакциях, образовывать соединения и обеспечивать многочисленные биологические функции. Например, ионы кальция и калия участвуют в сокращении мышц, а ионы натрия и хлора являются важными компонентами теловых жидкостей.
Электронейтральность атома: что это такое?
Электронейтральность атома — это свойство атома, при котором количество электронов в нем равно количеству протонов в его ядре. Когда атом электронейтрален, суммарный заряд ядра и облака электронов равен нулю.
Электроны — это негативно заряженные элементарные частицы, находящиеся вокруг ядра атома. Они имеют отрицательный заряд, который компенсирует положительный заряд протонов в ядре. Если электронов в атоме больше или меньше числа протонов, то этот атом приобретает положительный или отрицательный заряд соответственно.
В основном, все атомы стараются достичь электронейтральности, чтобы иметь стабильное состояние. Для этого атомы могут либо получать, либо отдавать электроны, чтобы соблюсти правило электронейтральности. Это достигается через химические реакции, в том числе обмен электронами между атомами.
Знание о электронейтральности атомов является фундаментальным в химии и физике и позволяет понять и предсказать поведение атомов и соединений в различных состояниях. При изучении химических связей и молекул электронейтральность является основой для понимания структуры и свойств вещества.
Значение электронейтральности атома является одной из важнейших концепций в науке и помогает объяснить различные явления, включая электростатическое взаимодействие между заряженными частицами и образование химических соединений.
Строение атома
Великие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
| Можно ли увидеть атом?Поскольку атомы невероятно малы по сравнению с длиной волны видимого света, их нельзя наблюдать даже с самым мощным в мире оптическим микроскопом. Вот почему ученые используют микроскоп другого типа, известный как сканирующий туннельный микроскоп. Он может обеспечить боковое разрешение 0,1 нм и разрешение по глубине 0,01 нм, что достаточно для изображения отдельных атомов в материалах. |
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы.
Можно провести аналогию: атом — это отдельный человек, а молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).
Молекулы — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки ученые-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē). В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
Электроны являются элементарными частицами, то есть неделимыми мельчайшими частицами. Протоны и нейтроны состоят из более мелких кварков, однако в рамках школьной программы кварки не рассматриваются, поэтому протоны и нейтроны мы также относим к элементарным частицам.
Каждая из элементарных частиц в атоме имеет свой заряд и массу.
| Чем атом похож на Солнечную систему?Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). Это так называемая планетарная модель атома. Планетарная модель наглядно описывает расположение элементарных частиц относительно друг друга, но не учитывает законы квантовой физики, а также не объясняет устойчивость атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться именно планетарным представлениями. |
Тогда более точно определение атома будет звучать так.
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Перейдем от теоретической информации к практической и научимся определять количество элементарных частиц в заданном атоме. Этот навык очень пригодится нам при решении заданий первой части!
Электронные конфигурации ионов.
Задача любого атома – перейти в наиболее выгодную для себя конфигурацию. Атом может либо принимать электроны до заполнения соответствующего уровня, либо отдавать их, для того, чтоб полностью очистить уровень.
В самом лучшем это приводит к тому, что элемент приобретает конфигцрацию инертного газа (представителя VIII-A группы).
Пример. Рассмотрим атом натрия:
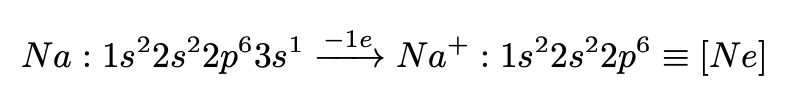
Необходимо заметить, что натрий приобрел положительный заряд (потерял отрицатель-
но заряженный электрон), теперь мы имеем дело с ионом.
Определение. Ион — заряженная частица.
Принимать электроны атом натрия не станет, это является общим правилом для всех металлов. Металлы не принимают электроны.
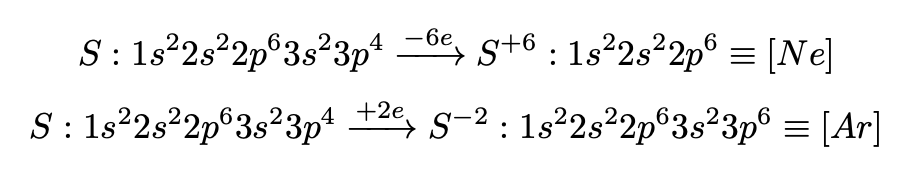
Значение для химии и науки в целом
Электронейтральные атомы являются основными строительными блоками всех веществ, из которых состоит наша Вселенная. Благодаря наличию одинакового количества электронов и протонов, они имеют нейтральный заряд и не обладают электрическим полем.
Количество электронейтральных атомов в веществе определяет его состав и свойства
Важное значение имеет также расположение электронов в атоме, которое определяет его химические свойства и возможность образования соединений
Изучение электронной структуры атомов является основой современной химии. Оно позволяет предсказывать, каким образом вещества будут взаимодействовать, какие соединения они образуют и какие свойства обладают
Все это важно для развития промышленности, медицины, технологии и многих других областей жизни
Важную роль электронейтральные атомы играют и в физике. Их взаимодействие с другими атомами и частицами, а также их поведение в различных условиях помогают уточнить фундаментальные законы природы и развивать новые технологии, например, в области создания компьютеров и электронных устройств.
Валентные и неспаренные электроны
Валентные электроны — электроны, способные участвовать в образовании химических связей.
Представим вкусный большой многослойный ягодный торт. Каждый слой — своего рода уровень. На слоях располагаются ягоды, они же электроны. Но самые вкусные (валентные) всегда располагают сверху на торте. То есть валентные электроны могут быть как на внешнем (в качестве украшения торта), так и на предвнешнем (верхнем бисквитном слое) энергетическом уровне.
Поэтому важно научиться определять количество валентных электронов для различных элементов:
- для элементов главных подгрупп — это все электроны внешнего уровня;
- для элементов побочных подгрупп — это электроны внешнего слоя и предвнешнего d-подуровня.
Среди валентных электронов есть как спаренные электроны, так и неспаренные.
Неспаренными называют электроны, которые находятся поодиночке на орбитали атома, соответственно, спаренные — всегда вдвоем.
Например, у атома водорода один неспаренный электрон на внешнем энергетическом уровне, а вот у атома гелия неспаренных электронов уже нет, но так как оба они находятся на внешнем (и в данном случае единственном) энергетическом уровне, они будут валентными.
Запоминалка: существует последовательность чисел, которая позволяет определить количество неспаренных электронов для атомов главных подгрупп: 1-0-1-2-3-2-1-0.
Таким образом, все неспаренные электроны являются валентными, но не все валентные электроны должны быть неспаренными.
Разберем еще один пример задания №1 ЕГЭ по химии.Задание. Определите, атомы каких из указанных в ряду элементов имеют одинаковое количество неспаренных электронов.1) Li 2) Ca 3) N 4) Ne 5) HРешение. Чтобы решить задание, нужно вспомнить последовательность чисел, которая позволяет определить количество неспаренных электроновдля атомов главных подгрупп: 1-0-1-2-3-2-1-0.Li — элемент IA группы (1-0-1-2-3-2-1-0), значит, у него один неспаренный электрон.Ca — элемент IIA группы (1—1-2-3-2-1-0), значит, у него нет неспаренных электронов.N — элемент VA группы (1-0-1-2-3-2-1-0), значит, у него три неспаренных электрона.Ne — элемент VIIIA группы (1-0-1-2-3-2-1-), значит, у него нет неспаренных электронов.H — элемент IA группы (1-0-1-2-3-2-1-0), значит, у него один неспаренный электрон.Ответ: 15
Строение атома — это тема, с которой всегда начинают познание химии, потому что приступать к изучению химических свойств веществ можно только с пониманием поведения элементарных частиц на атомарном уровне. Изучить тему подробнее и разобрать все ее тонкости поможет статья «Особенности строения электронных оболочек атомов переходных элементов».
Реактивность и химические реакции
Электронейтральный атом обладает высокой реактивностью, так как его электронная оболочка не является насыщенной. Это означает, что он стремится установить равновесие с окружающей средой, то есть найти другие атомы или молекулы, чтобы поделиться или получить электроны и достичь стабильности. Это происходит через химические реакции.
Химическая реакция — это процесс, в котором происходят изменения в составе вещества. При этом принимающий атом или молекула могут приобрести заряд, превращаясь в ион, или наоборот, отдать свой избыток электронов, чтобы стать более стабильным.
Электронейтральные атомы могут участвовать в различных химических реакциях, таких как окисление, восстановление, замещение, гидролиз и многих других. Реактивность атома зависит от его электроотрицательности, расположения в периодической системе, размеров, сложности и т.д.
Понимание реактивности электронейтрального атома необходимо для решения различных химических задач, в том числе и синтеза новых веществ, создания лекарств, разработки материалов и т.д.
примеров
кислород
Нейтральный атом кислорода имеет 8 протонов и 8 электронов. Когда он получает два электрона, он образует так называемый оксид аниона, ИЛИ2-. В нем преобладают отрицательные заряды, имеющие избыток двух электронов (8р
Нейтральные атомы кислорода имеют высокую склонность реагировать и связываться друг с другом с образованием О2. Именно по этой причине там нет ни атомов, ни «сыпучих» их судьбы и не реагирующих ни с чем. Все известные реакции для этого газа относятся к молекулярному кислороду, ИЛИ2.
медь
Медь имеет 29 протонов и 29 электронов (помимо нейтронов). В отличие от кислорода, его нейтральные атомы могут быть найдены в природе благодаря их металлической связи и относительной стабильности.
Как и натрий, он имеет тенденцию терять электроны, а не выигрывать их. Учитывая его электронную конфигурацию и другие аспекты, он может потерять один или два электрона, превращаясь в катионы меди, Cu+, или медь, Cu2+, соответственно.
Катион Cu+ имеет на один электрон меньше (29р2+ потерял два электрона (29p
Благородные газы
Благородные газы (He, Ne, Ar, Kr, Xe, Rn) являются одним из немногих элементов, которые существуют в форме их нейтральных атомов. Их атомные номера: 2, 10, 18, 36, 54 и 86 соответственно. Они не получают и не теряют электроны; хотя, ксенон, Xe, может образовывать соединения с фтором и терять электроны.
Металлические сплавы
Металлы, если они защищены от коррозии, могут сохранять свои нейтральные атомы, связанные металлическими связями. В сплавах твердых растворов металлов атомы остаются (в основном) нейтральными. В латуни, например, есть нейтральные атомы Cu и Zn.
Немного истории нейтрино
Давным-давно, на рубеже двадцатого века,
физики начали вглядываться в субатомные
область.
Их инструменты, наконец, становились все более изощренными.
достаточно, чтобы разбить на атомы и обнаружить отдельные
частицы.![]()
Чтобы сильно упростить, ученые определили, что атомы
были сделаны из более мелких частиц.
Самые ранние идеи заключались в том, что эти частицы
в двух разновидностях:
- положительно заряженные частицы (которые мы теперь называем протонами )
- отрицательно заряженных частицы (которые мы теперь называем электронами )
Они быстро поняли, что электроны менее массивны и менее массивны.
легче манипулировать, чем протонами, так как положительные заряды
были сгруппированы рядом с центром атомов
в плотном шарике мы называем ядром.
Было обнаружено, что некоторые атомы самопроизвольно распадаются на
новые формы — процесс под названием , радиоактивность .
Один из видов радиоактивности, известный как бета-распад,
участие в создании протона и электрона вместе,
после чего электрон отлетел от атома с большой энергией
и импульс.
Например,
В исходном атоме было 6 протонов и 6 электронов, а
был электрически нейтрален.![]()
сохранение электрического заряда
Однако… были и другие свойства, которые казались
НЕ должны быть сохранены этим процессом.
Например, электрон оторвался от атома.
с высокой скоростью, забирая с собой энергию и импульс.
Атом немного отпрянул,
но тщательные измерения показали, что общая
энергия (дочернего атома плюс электрон) была не такой
большой, как энергия исходного атома;
более того, импульс
(дочерний атом-плюс-электрон) также не был равен
к импульсу исходного атома.
Оказалось, что бета-распад нарушается сохранение энергии и сохранение импульса .
Это было плохо.
В 1930 году Вольфганг Паули предположил, что, возможно,
третья частица участвовала в бета-распаде.
Предположим, сказал он, что когда протон и электрон
создаются внутри атома, НЕЙТРАЛЬНОЙ частицы
также создается.![]()
В 1932 была обнаружена нейтральная частица,
и получил название нейтрон .
Увы, нужных свойств у него не было
исправить проблемы с бета-распадом.
Крысы.
Когда физики поняли, что нейтрон не может
объяснить недостающую энергию и импульс,
они постулировали, что другая нейтральная частица
также должны существовать.
Поскольку эта частица, казалось, имела небольшую массу,
ему дали название нейтрино ,
итальянское уменьшительное, означающее «милая маленькая нейтральная частица».
(Ну, может быть, без «милого»).
После многих лет поисков нейтрино
был окончательно обнаружен в 1956 г.
командой под руководством Клайда Коуэна и Фредерика Рейнса.
За этот потрясающий экспериментальный подвиг
Рейнесу была присуждена доля Нобелевской премии по физике.
в 1995 году;
Коуэн, к сожалению, умер в 1974 году и, таким образом,
не имеет права на получение своей доли Премии.![]()
Почему нейтрино так трудно найти?
Почему ученым потребовалось так много времени, чтобы обнаружить
эта частица?
Одной из причин является отсутствие заряда:
частицы с электрическим зарядом действуют с большими силами
на другие частицы, и поэтому их легко заметить.
Но оказалось, что нейтрино
очень странная частица:
он очень, очень, ОЧЕНЬ слабо взаимодействовал с материей,
гораздо слабее, чем любая другая частица.
Как слабо?
Что ж, давайте сравним его с другими товарами, произведенными
процессами радиоактивного распада.
Частицы, которые сильно взаимодействуют, будут сталкиваться
атомы очень скоро после попадания в кусок материи,
а те, которые взаимодействуют слабо, пройдут
некоторое расстояние до столкновения с атомом.
| Имя | также известный как | можно остановить с помощью |
| альфа-луч | ядро гелия | лист бумаги, слой кожи |
| бета-луч | электрон | несколько листов алюминиевой фольги |
| гамма-излучение | фотон высокой энергии | свинцовые кирпичи |
Эти свойства показывают, что альфа-частицы сильно взаимодействуют с
вещество, тогда как гамма-лучи взаимодействуют относительно слабо.![]()

















![Электронная оболочка атома и спектры [1972 семишин в.и. - периодическая система химических элементов д. и. менделеева]](http://podomu.info/wp-content/uploads/0/b/c/0bc1790eeb4b59ee0acced4a1c729c2c.jpeg)







