Влияние на атомные свойства
Сходная конфигурация внешнего энергетического уровня имеет важное влияние на атомные свойства. Она определяет химическое поведение и реакционную способность атома
Атомы с одинаковой конфигурацией внешнего энергетического уровня обладают сходными свойствами. Например, атомы с одинаковым числом валентных электронов на последнем энергетическом уровне имеют сходную химическую активность и способность образовывать химические связи.
Также сходная конфигурация внешнего энергетического уровня определяет основные физические свойства атомов. Например, атомы с одинаковым числом валентных электронов на последнем энергетическом уровне имеют сходные размеры и массы.
Изменение конфигурации внешнего энергетического уровня может приводить к изменению атомных свойств. Например, добавление или удаление валентных электронов может изменить химическую активность атома и его способность образовывать химические соединения.
Кроме того, сходная конфигурация внешнего энергетического уровня позволяет классифицировать атомы и элементы в таблицах Менделеева. Она помогает организовать элементы в группы и периоды, упрощая изучение и анализ химических свойств атомов.
| Атомный свойство | Влияние сходной конфигурации внешнего энергетического уровня |
|---|---|
| Химическая активность | Атомы с одинаковой конфигурацией внешнего энергетического уровня имеют сходную химическую активность и способность образовывать химические связи. |
| Размеры и массы | Атомы с одинаковым числом валентных электронов на последнем энергетическом уровне имеют сходные размеры и массы. |
| Классификация элементов | Сходная конфигурация внешнего энергетического уровня помогает классифицировать атомы и элементы в таблицах Менделеева. |
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Сходная конфигурация внешнего энергетического уровня
Сходная конфигурация внешнего энергетического уровня является важным параметром в химии и физике атомов и молекул. Под сходной конфигурацией внешнего энергетического уровня понимается совпадение числа электронов в неполностью заполненном внешнем энергетическом уровне у двух или более атомов или молекул.
Эта сходная конфигурация приводит к подобной химической реактивности, т.к. атомы и молекулы схожего типа могут образовывать стабильные соединения между собой. Например, галогены (фтор, хлор, бром и йод) обладают сходной конфигурацией внешнего энергетического уровня — у них семь электронов в неполностью заполненном внешнем энергетическом уровне. Именно благодаря этому они могут образовывать между собой стабильные молекулы.
Также сходная конфигурация придаёт металлам сходные свойства. Например, все щелочные металлы (литий, натрий, калий и др.) имеют сходную конфигурацию внешнего энергетического уровня, у них один электрон в неполностью заполненном внешнем энергетическом уровне. Поэтому они имеют схожие химические свойства, такие как высокая реактивность и способность образовывать щелочные растворы.
В целом, сходная конфигурация внешнего энергетического уровня важна для понимания химических свойств элементов и соединений, и используется как в исследованиях, так и в технологиях.
Химическая связь и строение вещества
article>ÐÑе ÑиÑÑÐµÐ¼Ñ ÑÑÑемÑÑÑÑ Ðº ÑавновеÑÐ¸Ñ Ð¸ к ÑменÑÑÐµÐ½Ð¸Ñ Ñвободной ÑнеÑгии â Ñак глаÑÐ¸Ñ Ð¾Ð´Ð¸Ð½ из поÑÑÑлаÑов ÑимиÑеÑкой ÑеÑмодинамики. ÐÑомÑ, взаимодейÑÑвÑÑÑие в молекÑле веÑеÑÑва, Ñоже подÑинÑÑÑÑÑ ÑÑÐ¾Ð¼Ñ Ð·Ð°ÐºÐ¾Ð½Ñ. Ðни ÑÑÑемÑÑÑÑ Ð¾Ð±ÑазоваÑÑ ÑÑÑойÑивÑÑ ÐºÐ¾Ð½ÑигÑÑаÑÐ¸Ñ â 8-ÑлекÑÑоннÑÑ Ð¸Ð»Ð¸ 2-ÑлекÑÑоннÑÑ Ð²Ð½ÐµÑнÑÑ Ð¾Ð±Ð¾Ð»Ð¾ÑкÑ. ÐÑÐ¾Ñ Ð¿ÑоÑеÑÑ Ð²Ð·Ð°Ð¸Ð¼Ð¾Ð´ÐµÐ¹ÑÑÐ²Ð¸Ñ Ð½Ð°Ð·ÑваеÑÑÑ ÑимиÑеÑкой ÑвÑзÑÑ, благодаÑÑ ÐµÐ¼Ñ Ð¿Ð¾Ð»ÑÑаÑÑÑÑ Ð¼Ð¾Ð»ÐµÐºÑÐ»Ñ Ð¸ молекÑлÑÑнÑе ÑоединениÑ.
| ХимиÑеÑÐºÐ°Ñ ÑвÑÐ·Ñ â ÑÑо взаимодейÑÑвие Ð¼ÐµÐ¶Ð´Ñ Ð°Ñомами в молекÑле веÑеÑÑва, в Ñоде коÑоÑого два ÑлекÑÑона (по Ð¾Ð´Ð½Ð¾Ð¼Ñ Ð¾Ñ ÐºÐ°Ð¶Ð´Ð¾Ð³Ð¾ аÑома) обÑазÑÑÑ Ð¾Ð±ÑÑÑ ÑлекÑÑоннÑÑ Ð¿Ð°ÑÑ Ð»Ð¸Ð±Ð¾ ÑлекÑÑон пеÑеÑÐ¾Ð´Ð¸Ñ Ð¾Ñ Ð¾Ð´Ð½Ð¾Ð³Ð¾ аÑома к дÑÑгомÑ. |
Ðак понÑÑно из опÑÐµÐ´ÐµÐ»ÐµÐ½Ð¸Ñ ÑимиÑеÑкой ÑвÑзи, пÑи взаимодейÑÑвии двÑÑ Ð°Ñомов один из Ð½Ð¸Ñ Ð¼Ð¾Ð¶ÐµÑ Ð¿ÑиÑÑнÑÑÑ Ðº Ñебе внеÑние ÑлекÑÑÐ¾Ð½Ñ Ð´ÑÑгого. ÐÑа ÑпоÑобноÑÑÑ Ð½Ð°Ð·ÑваеÑÑÑ ÑлекÑÑооÑÑиÑаÑелÑноÑÑÑÑ (ÐÐ). ÐÑом Ñ Ð±Ð¾Ð»ÐµÐµ вÑÑокой ÑлекÑÑооÑÑиÑаÑелÑноÑÑÑÑ (ÐÐ) пÑи обÑазовании ÑимиÑеÑкой ÑвÑзи Ñ Ð´ÑÑгим аÑомом Ð¼Ð¾Ð¶ÐµÑ Ð²ÑзваÑÑ ÑмеÑение к Ñебе обÑей ÑлекÑÑонной паÑÑ.
Ðажно!
СÑÑеÑÑвÑÐµÑ Ð½ÐµÑколÑко ÑиÑÑем измеÑÐµÐ½Ð¸Ñ ÐÐ, но полÑзоваÑÑÑÑ Ð´Ð»Ñ ÑаÑÑеÑов можно лÑбой из ниÑ. ÐÐ»Ñ Ð¾Ð±ÑÐ°Ð·Ð¾Ð²Ð°Ð½Ð¸Ñ ÑимиÑеÑкой ÑвÑзи важно не конкÑеÑное знаÑение ÐÐ, а ÑазниÑа Ð¼ÐµÐ¶Ð´Ñ ÑÑими показаÑелÑми Ñ Ð´Ð²ÑÑ Ð°Ñомов.

Особенности электронного строения атома углерода
В 10-м классе вы будете изучать органическую химию — химию соединений углерода. Уникальность этого элемента заключается в том, что число электронов на внешнем энергетическом уровне углерода (их четыре) равно числу орбиталей (которых также четыре). То есть у атома углерода внешний энергетический уровень заполнен ровно наполовину. В таком случае атому невыгодно как отдавать, так и принимать электроны, а выгодно их обобществлять, образуя ковалентные связи. Поэтому атомы углерода образуют достаточно прочные связи друг с другом, соединяясь в длинные цепи или циклы. При этом каждый атом углерода образует четыре ковалентные связи.
На рисунке 2.4 показаны цепи и циклы из атомов углерода в молекулах органических веществ. Свободные валентности атомов углерода заполнены атомами водорода (белые шарики):
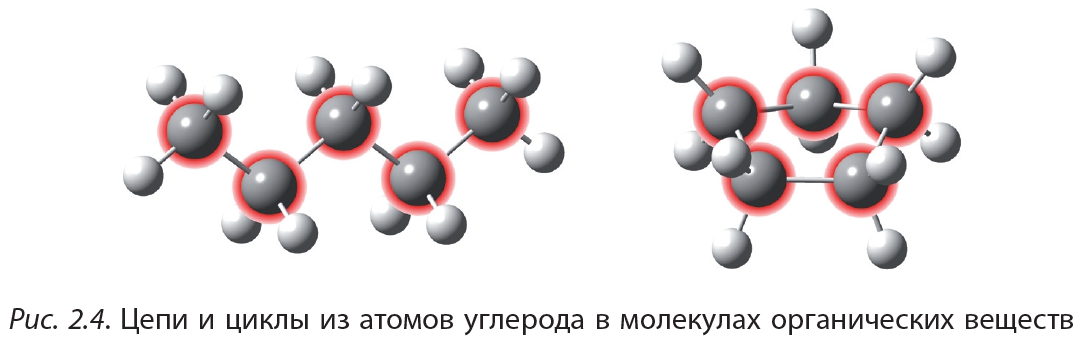
Неудивительно, что углерод является основой множества органических соединений. Валентность углерода, равная четырём, даёт возможность образования разветвлённых структур и кратных (двойных и тройных) связей, что обусловливает многообразие органических соединений.
Вопросы и задания
1. Сколько электронов может располагаться на одной орбитали?
2. Сколько орбиталей имеется на первом и на втором энергетических уровнях соответственно?
3. Определите степени окисления элементов в следующих соединениях: HF, H2SO4, H2, NH3, CH4.
4. Почему бериллий, имеющий электронную конфигурацию 1s22s2, является активным металлом, тогда как гелий с похожей электронной конфигурацией внешнего энергетического уровня (1s2) — благородным газом?
5. В чём уникальность строения атома углерода, позволяющего ему быть основой для молекул миллионов органических соединений?
6. Химический элемент, электронная конфигурация которого …2s22p2, образует оксид, массовая доля кислорода в котором равна 72,7 %. Приведите химический символ элемента и формулу оксида.
7. Какие из приведённых электронных конфигураций соответствуют основному состоянию атома, а какие — возбуждённому: а) 1s22s22p2; б) 1s22s12p2; в) 1s22s22p5; г) 1s22s22p6; д) 1s22s12p3?
8*. Почему такие элементы, как сера, фосфор, хлор, являются поливалентными?
Важность внешней электронной конфигурации
Электронные конфигурации играют важную роль в определении свойств атомов.
Все атомы одной группы имеют одинаковую внешнюю электронную конфигурацию, за исключением атомного номера n, поэтому они имеют сходные химические свойства.
Некоторые из ключевых факторов, которые влияют на атомные свойства, включают размер самых больших занятых орбиталей, энергию орбиталей с более высокой энергией, количество орбитальных вакансий и число электронов на орбитали с более высокой энергией (Электронные конфигурации и Свойства атомов, SF).
Большинство атомных свойств могут быть связаны со степенью притяжения между электронами, более внешними по отношению к ядру, и количеством электронов в крайнем электронном слое, количеством валентных электронов..
Электроны внешнего слоя — это те, которые могут образовывать ковалентные химические связи, те, которые способны ионизироваться с образованием катионов или анионов, и те, которые дают степень окисления химическим элементам (Хан, 2014)..
Они также будут определять атомный радиус. Когда n становится больше, атомный радиус увеличивается. Когда атом теряет электрон, происходит сокращение атомного радиуса из-за уменьшения отрицательного заряда вокруг ядра.
Электроны внешнего слоя — это те, которые учитываются теорией валентных связей, теорией кристаллического поля и теорией молекулярных орбиталей для получения свойств молекул и гибридизации связей (Bozeman Science, 2013).
ссылки
- Принцип Ауфбау. (2015, 3 июня). Получено из chem.libretexts: chem.libretexts.org.
- Бозман Наука. (2013, Агото 4). Электронная конфигурация. Взято с youtube: youtube.com.
- Электронные конфигурации и свойства атомов. (S.F.). Взято из oneonta.edu: oneonta.edu.
- Энциклопедия Британника. (2011 г., 7 сентября). Электронная конфигурация. Взято с британницы: britannica.com.
- Файзи С. (2016, 12 июля). Электронные конфигурации. Взято из chem.libretexts: chem.libretexts.org.
- Helmenstine, T. (2017, 7 марта). Принцип Ауфбау — электронная структура и принцип Ауфбау. Взято из мысли: мысли.
- Хан С. (2014, 8 июня). Валентные электроны и связь. Взято из ханакадемии: khanacademy.org.
Примеры элементов
Одним из примеров элементов сходной конфигурации внешнего энергетического уровня является набор элементов группы железа. В эту группу входят железо (Fe), кобальт (Co) и никель (Ni). Все они имеют по шесть электронов на внешнем энергетическом уровне и могут образовывать соединения с различными элементами, при этом имея сходные свойства и химическую активность.
Другим примером является группа элементов, называемая инертными газами или газами благородных металлов. В эту группу входят элементы неона (Ne), аргона (Ar), криптона (Kr), ксенона (Xe) и радона (Rn). Все они имеют полностью заполненный внешний энергетический уровень и не образуют соединений с другими элементами.
Еще одним примером являются элементы группы углерода, которые имеют по четыре электрона на внешнем энергетическом уровне и могут образовывать множество соединений.
- Углерод (C)
- Кремний (Si)
- Германий (Ge)
- Олово (Sn)
- Свинец (Pb)
Все эти элементы имеют сходный химический характер и могут образовывать соединения с другими элементами, например, с водородом.
Сравнение свойств элементов группы углерода
Элемент
Плотность, г/см³
Температура плавления, °C
Углерод
2,267
3 500
Кремний
2,33
1 410
Германий
5,323
938,3
Олово
7,31
231,9
Свинец
11,34
327,5
Элементы одного периода
Период в таблице химических элементов представляет собой горизонтальную строку, на которой располагаются элементы с одинаковым количеством энергетических уровней. Каждый следующий элемент в периоде имеет на один протон больше, что приводит к увеличению заряда ядра и числа электронов в оболочке.
На примере элементов одного периода можно наблюдать закономерные изменения химических свойств. При движении слева направо по периоду происходит увеличение атомного радиуса (размера атома) и электроотрицательности элементов. Это связано с увеличением числа протонов в ядре и притяжением электронов к ядру. В то же время, число энергетических уровней остается постоянным в пределах одного периода.
Элементы одного периода обладают сходными химическими свойствами. Например, элементы первого периода (водород и гелий) являются газами, а элементы второго периода (литий, бериллий, бор, углерод и т.д.) образуют соединения с кислородом, образуя оксиды.
Валентные и неспаренные электроны
Валентные электроны — электроны, способные участвовать в образовании химических связей.
Представим вкусный большой многослойный ягодный торт. Каждый слой — своего рода уровень. На слоях располагаются ягоды, они же электроны. Но самые вкусные (валентные) всегда располагают сверху на торте. То есть валентные электроны могут быть как на внешнем (в качестве украшения торта), так и на предвнешнем (верхнем бисквитном слое) энергетическом уровне.
Поэтому важно научиться определять количество валентных электронов для различных элементов:
- для элементов главных подгрупп — это все электроны внешнего уровня;
- для элементов побочных подгрупп — это электроны внешнего слоя и предвнешнего d-подуровня.
Среди валентных электронов есть как спаренные электроны, так и неспаренные.
Неспаренными называют электроны, которые находятся поодиночке на орбитали атома, соответственно, спаренные — всегда вдвоем.
Например, у атома водорода один неспаренный электрон на внешнем энергетическом уровне, а вот у атома гелия неспаренных электронов уже нет, но так как оба они находятся на внешнем (и в данном случае единственном) энергетическом уровне, они будут валентными.
Запоминалка: существует последовательность чисел, которая позволяет определить количество неспаренных электронов для атомов главных подгрупп: 1-0-1-2-3-2-1-0.
Таким образом, все неспаренные электроны являются валентными, но не все валентные электроны должны быть неспаренными.
Разберем еще один пример задания №1 ЕГЭ по химии.Задание. Определите, атомы каких из указанных в ряду элементов имеют одинаковое количество неспаренных электронов.1) Li 2) Ca 3) N 4) Ne 5) HРешение. Чтобы решить задание, нужно вспомнить последовательность чисел, которая позволяет определить количество неспаренных электроновдля атомов главных подгрупп: 1-0-1-2-3-2-1-0.Li — элемент IA группы (1-0-1-2-3-2-1-0), значит, у него один неспаренный электрон.Ca — элемент IIA группы (1—1-2-3-2-1-0), значит, у него нет неспаренных электронов.N — элемент VA группы (1-0-1-2-3-2-1-0), значит, у него три неспаренных электрона.Ne — элемент VIIIA группы (1-0-1-2-3-2-1-), значит, у него нет неспаренных электронов.H — элемент IA группы (1-0-1-2-3-2-1-0), значит, у него один неспаренный электрон.Ответ: 15
Строение атома — это тема, с которой всегда начинают познание химии, потому что приступать к изучению химических свойств веществ можно только с пониманием поведения элементарных частиц на атомарном уровне. Изучить тему подробнее и разобрать все ее тонкости поможет статья «Особенности строения электронных оболочек атомов переходных элементов».
Строение атома
Великие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
| Можно ли увидеть атом?Поскольку атомы невероятно малы по сравнению с длиной волны видимого света, их нельзя наблюдать даже с самым мощным в мире оптическим микроскопом. Вот почему ученые используют микроскоп другого типа, известный как сканирующий туннельный микроскоп. Он может обеспечить боковое разрешение 0,1 нм и разрешение по глубине 0,01 нм, что достаточно для изображения отдельных атомов в материалах. |
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы.
Можно провести аналогию: атом — это отдельный человек, а молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).
Молекулы — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки ученые-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē). В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
Электроны являются элементарными частицами, то есть неделимыми мельчайшими частицами. Протоны и нейтроны состоят из более мелких кварков, однако в рамках школьной программы кварки не рассматриваются, поэтому протоны и нейтроны мы также относим к элементарным частицам.
Каждая из элементарных частиц в атоме имеет свой заряд и массу.
| Чем атом похож на Солнечную систему?Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). Это так называемая планетарная модель атома. Планетарная модель наглядно описывает расположение элементарных частиц относительно друг друга, но не учитывает законы квантовой физики, а также не объясняет устойчивость атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться именно планетарным представлениями. |
Тогда более точно определение атома будет звучать так.
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Перейдем от теоретической информации к практической и научимся определять количество элементарных частиц в заданном атоме. Этот навык очень пригодится нам при решении заданий первой части!
Какие свойства элементов изменяются в периодах и группах?
Свойства элементов в периодах и группах
Свойства химических элементов изменяются периодически по периодам и группам в таблице Менделеева. Важнейшими характеристиками элементов, которые изменяются периодически, являются радиус атома, энергия ионизации, электроотрицательность, металлические свойства, кислотные свойства, и другие.
Изменение свойств элементов по периодам
В периоде уменьшается радиус атома, увеличивается заряд ядра атома, возрастает число электронов на внешнем энергетическом уровне, уменьшается способность атомов отдавать электроны, металлические свойства, низшие степени окисления, а увеличивается электроотрицательность, способность атомов принимать электроны, кислотные свойства высших оксидов и гидроксидов.
Изменение свойств элементов по группам
В группе сверху вниз увеличивается радиус атома, возрастают металлические свойства, убывают неметаллические свойства, уменьшается электроотрицательность. Чем больше номер группы, тем больше электронов на внешнем энергетическом уровне (их количество равно номеру группы), и тем больше металлических свойств проявляет элемент.
Примеры изменения свойств элементов
Например, в периоде уменьшается радиус атома, а в группе увеличивается количество электронов на внешнем энергетическом уровне, что приводит к увеличению металлических свойств элемента. Самый сильный металл в каждой группе располагается вверху, а самый сильный неметалл в каждой группе располагается внизу.
Квантовые числа
У каждого взрослого человека есть жизненно важные документы: паспорт, СНИЛС, медицинский полис и другие. У электрона тоже есть свои важнейшие «документы» — набор квантовых чисел:
- главное квантовое число (n);
- орбитальное квантовое число (l);
- магнитное квантовое число (ml);
- спиновое квантовое число (ms).
Главное квантовое число (n) характеризует номер энергетического уровня атома.
Главное квантовое число численно равно номеру периода.
Принимает значения: 1, 2, 3,….∞. Однако на сегодняшний день максимальным главным квантовым числом является 7, так как в таблице Менделеева всего 7 периодов. Например, главное квантовое число атома фосфора (P) равно трем, так как этот элемент находится в третьем периоде.
Орбитальное квантовое число (l), или его еще называют побочным квантовым числом, определяет форму атомных орбиталей (траекторий движения электрона).
Определить l можно по формуле:
l=n-1, гдеn — это главное квантовое число.
Максимально возможное орбитальное число всегда будет на единицу меньше главного квантового числа.
Важно помнить, что количество атомных орбиталей на каждом уровне равно номеру этого уровня.
Например, фосфор, находящийся в третьем периоде, имеет на первом энергетическом уровне одну атомную орбиталь (s), на втором — две (s и p), на третьем — три (s, p и d). То есть атом фосфора имеет три разных по энергии, но одинаковые по форме s-орбитали – на первом, втором и третьем энергетических уровнях.
Магнитное квантовое число (ml) определяет количество атомных орбиталей (ячеек).
Оно рассчитывается по формуле:
ml =2l+1, гдеl – это орбитальное квантовое число.
Например, у атома фосфора главное квантовое число n=3; орбитальное квантовое число l=3-1=2 (d-орбиталь); магнитное квантовое число ml =2 · 2+1=5. Таким образом делаем вывод, что на третьем (n) энергетическом уровне у фосфора находится пять (ml) различных по энергии d-орбиталей (l).
Спиновое квантовое число (ms) характеризует собственное движение электрона — спин.
Как мы уже сказали, спиновое квантовое число характеризует движение электрона вокруг ядра атома. То есть атом может двигаться как по часовой, так и против часовой стрелки. Это очень напоминает спиннер (вращающаяся игрушка). Более того, понятия «спиновый» и «спиннер» созвучны, что позволяет без труда вспомнить смысл этого квантового числа.
Расчеты главного, орбитального и магнитного квантовых чисел приведены в таблице.
Квантовые числа позволяют нам собрать информацию о строении атома химического элемента, о распределении его электронов, чтобы затем составить «паспорт».
Механизм образования химической ковалентной связи
article>СÑÑеÑÑвÑÐµÑ Ð´Ð²Ð° меÑанизма взаимодейÑÑÐ²Ð¸Ñ Ð°Ñомов:
-
обменнÑй â пÑÐµÐ´Ð¿Ð¾Ð»Ð°Ð³Ð°ÐµÑ Ð²Ñделение по Ð¾Ð´Ð½Ð¾Ð¼Ñ Ð²Ð½ÐµÑÐ½ÐµÐ¼Ñ ÑлекÑÑÐ¾Ð½Ñ Ð¾Ñ ÐºÐ°Ð¶Ð´Ð¾Ð³Ð¾ аÑома и Ñоединение Ð¸Ñ Ð² обÑÑÑ Ð¿Ð°ÑÑ;
-
доноÑно-акÑепÑоÑнÑй â пÑоиÑÑодиÑ, когда один аÑом (доноÑ) вÑделÑÐµÑ Ð´Ð²Ð° ÑлекÑÑона, а вÑоÑой аÑом (акÑепÑоÑ) пÑÐ¸Ð½Ð¸Ð¼Ð°ÐµÑ Ð¸Ñ Ð½Ð° ÑÐ²Ð¾Ñ ÑвободнÑÑ Ð¾ÑбиÑалÑ.
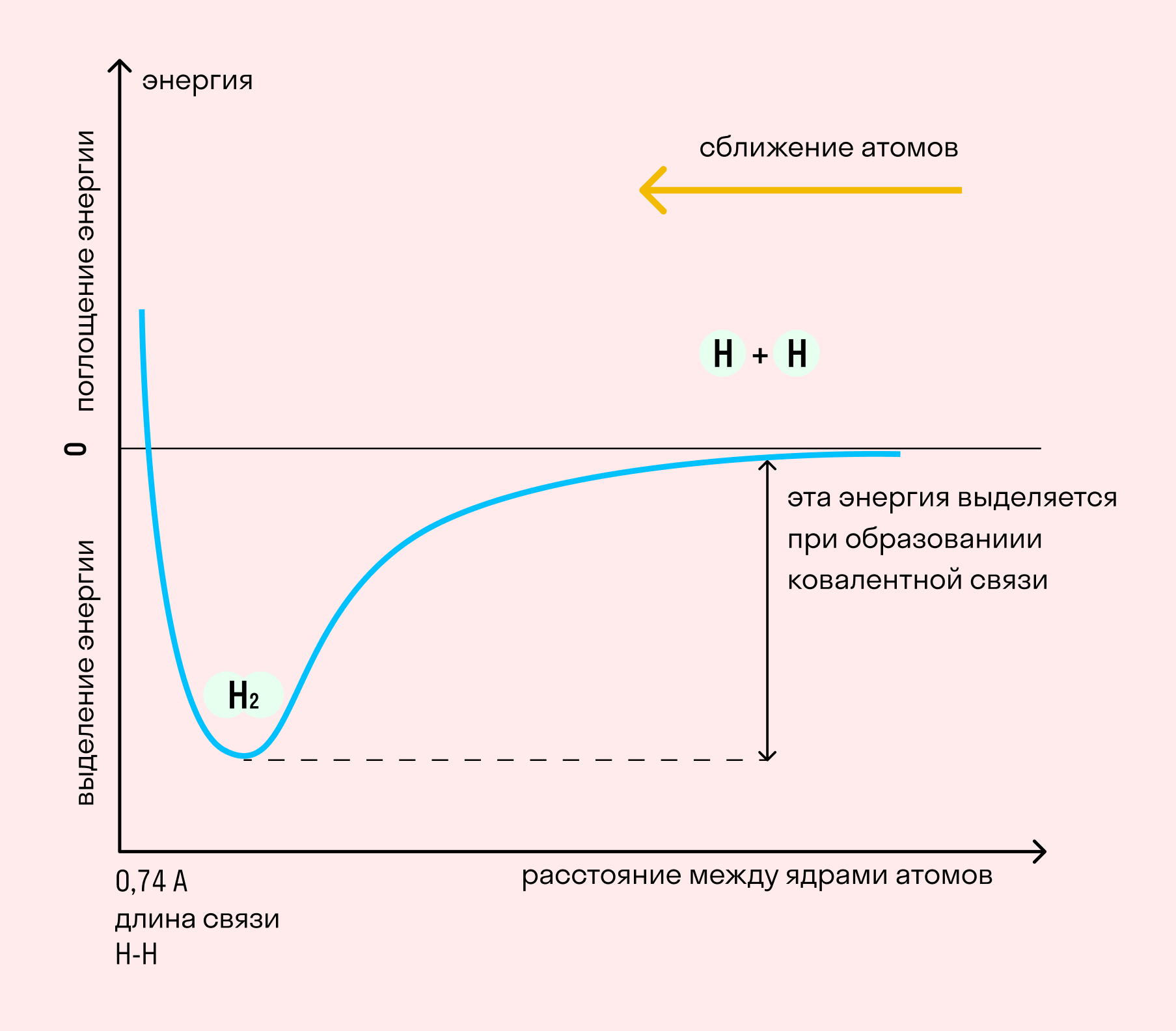
ÐезавиÑимо Ð¾Ñ Ð¼ÐµÑанизма ÑимиÑеÑÐºÐ°Ñ ÑвÑÐ·Ñ Ð¼ÐµÐ¶Ð´Ñ Ð°Ñомами ÑопÑовождаеÑÑÑ Ð²Ñделением ÑнеÑгии. Чем вÑÑе ÐРаÑомов, Ñ. е. Ð¸Ñ ÑпоÑобноÑÑÑ Ð¿ÑиÑÑгиваÑÑ ÑлекÑÑонÑ, Ñем ÑилÑнее и ÑÑÐ¾Ñ ÑнеÑгеÑиÑеÑкий вÑплеÑк.
| ÐнеÑгией ÑвÑзи назÑваÑÑ ÑÑ ÑнеÑгиÑ, коÑоÑÐ°Ñ Ð²ÑделÑеÑÑÑ Ð¿Ñи взаимодейÑÑвии аÑомов. Ðна опÑеделÑÐµÑ Ð¿ÑоÑноÑÑÑ ÑимиÑеÑкой ÑвÑзи и по велиÑине Ñавна ÑÑилиÑ, необÑÐ¾Ð´Ð¸Ð¼Ð¾Ð¼Ñ Ð´Ð»Ñ ÐµÐµ ÑазÑÑва. |
Также на пÑоÑноÑÑÑ Ð²Ð»Ð¸ÑÑÑ ÑледÑÑÑие показаÑели:
-
Ðлина ÑвÑзи â ÑаÑÑÑоÑние Ð¼ÐµÐ¶Ð´Ñ ÑдÑами аÑомов. С ÑменÑÑением ÑÑого ÑаÑÑÑоÑÐ½Ð¸Ñ ÑаÑÑÐµÑ ÑнеÑÐ³Ð¸Ñ ÑвÑзи и ÑвелиÑиваеÑÑÑ ÐµÐµ пÑоÑноÑÑÑ.
-
ÐÑаÑноÑÑÑ ÑвÑзи â колиÑеÑÑво ÑлекÑÑоннÑÑ Ð¿Ð°Ñ, поÑвивÑиÑÑÑ Ð¿Ñи взаимодейÑÑвии аÑомов. Чем болÑÑе ÑÑо ÑиÑло, Ñем вÑÑе ÑнеÑÐ³Ð¸Ñ Ð¸, ÑооÑвеÑÑÑвенно, пÑоÑноÑÑÑ ÑвÑзи.
Ðа пÑимеÑе ÑимиÑеÑкой ÑвÑзи в молекÑле водоÑода поÑмоÑÑим, как менÑеÑÑÑ ÑнеÑÐ³Ð¸Ñ ÑиÑÑÐµÐ¼Ñ Ð¿Ñи ÑокÑаÑении ÑаÑÑÑоÑÐ½Ð¸Ñ Ð¼ÐµÐ¶Ð´Ñ ÑдÑами аÑомов. Ðо меÑе ÑÐ±Ð»Ð¸Ð¶ÐµÐ½Ð¸Ñ ÑÐ´ÐµÑ ÑлекÑÑоннÑе оÑбиÑали ÑÑÐ¸Ñ Ð°Ñомов наÑинаÑÑ Ð¿ÐµÑекÑÑваÑÑ Ð´ÑÑг дÑÑга, в иÑоге поÑвлÑеÑÑÑ Ð¾Ð±ÑÐ°Ñ Ð¼Ð¾Ð»ÐµÐºÑлÑÑÐ½Ð°Ñ Ð¾ÑбиÑалÑ. ÐеÑпаÑеннÑе ÑлекÑÑÐ¾Ð½Ñ ÑеÑез облаÑÑи пеÑекÑÑÐ²Ð°Ð½Ð¸Ñ ÑмеÑаÑÑÑÑ Ð¾Ñ Ð¾Ð´Ð½Ð¾Ð³Ð¾ аÑома в ÑÑоÑÐ¾Ð½Ñ Ð´ÑÑгого, возникаÑÑ Ð¾Ð±Ñие ÑлекÑÑоннÑе паÑÑ. ÐÑе ÑÑо ÑопÑовождаеÑÑÑ Ð½Ð°ÑаÑÑаÑÑим вÑделением ÑнеÑгии. Сближение пÑоиÑÑÐ¾Ð´Ð¸Ñ Ð´Ð¾ ÑÐµÑ Ð¿Ð¾Ñ, пока ÑÐ¸Ð»Ñ Ð¿ÑиÑÑÐ¶ÐµÐ½Ð¸Ñ Ð½Ðµ компенÑиÑÑÐµÑ Ñила оÑÑÐ°Ð»ÐºÐ¸Ð²Ð°Ð½Ð¸Ñ Ð¾Ð´Ð½Ð¾Ð¸Ð¼ÐµÐ½Ð½ÑÑ Ð·Ð°ÑÑдов.
Задачи
Задача 1
Определите гибридизацию атома азота в аммиаке (NH3).
Решение:
Нарисуйте структуру Льюиса аммиака (NH3).
H|H — N — H|H
Определите количество областей электронной плотности вокруг атома азота. В аммиаке атом азота имеет три области связи и одну одиночную пару, что дает ему в общей сложности четыре области электронной плотности.
Используйте число областей электронной плотности, чтобы предсказать гибридизацию атома азота. В данном случае атом азота должен подвергнуться sp3-гибридизации, поскольку он имеет четыре области электронной плотности.
Присвойте атому азота соответствующие орбитали. Гибридизация sp3 азота включает в себя комбинацию одной s- и трех p-орбиталей, в результате чего образуются четыре гибрида sp3, ориентированные в тетраэдрической геометрии. Три из них будут использоваться для образования связей азота с водородом, а четвертая орбиталь будет содержать одинокую пару электронов.
Задача 2
Определите гибридизацию атома углерода в этине (C2H2).
Решение:
Нарисуйте структуру Льюиса этина (C2H2).
H-C≡C-H
Определите число областей электронной плотности вокруг атома углерода. В этине атом углерода имеет две области связи и ни одной одиночной пары, что дает ему в общей сложности две области электронной плотности.
Используйте число областей электронной плотности, чтобы предсказать гибридизацию атома углерода. В данном случае атом углерода должен подвергнуться sp-гибридизации, поскольку он имеет две области электронной плотности.
Назначьте атому углерода соответствующие орбитали. При sp-гибридизации углерода происходит комбинация одной s- и одной p-орбитали, в результате чего образуются две орбитали sp, ориентированные в линейной геометрии. Эти две орбитали будут использоваться для образования тройной связи углерод-углерод.




























