Безопасность при использовании второго бутила
Первое, что необходимо помнить, это то, что второй бутил является воспламеняющимся веществом
Поэтому при его использовании необходимо принимать меры предосторожности, чтобы избежать возгорания. Работа с вторым бутилом должна проводиться только в хорошо проветриваемых помещениях с использованием специального оборудования и средств индивидуальной защиты. Также следует избегать смешивания второго бутила с веществами, которые могут вызывать химические реакции или образование взрывоопасных смесей
Также следует избегать смешивания второго бутила с веществами, которые могут вызывать химические реакции или образование взрывоопасных смесей.
Второй бутил также является раздражающим веществом. При попадании на кожу или в глаза может вызывать раздражение, сухость и покраснение. Для предотвращения контакта с кожей рекомендуется использовать специальные рукавицы и защитные очки. В случае контакта следует немедленно промыть затронутую область водой и обратиться за медицинской помощью при необходимости.
Еще одним аспектом безопасности является правильное хранение и утилизация второго бутила. Он должен храниться в специальных контейнерах, которые обеспечивают его сохранность и предотвращают возможность утечки или испарения
При выбросе или утилизации второго бутила необходимо соблюдать все меры предосторожности и соблюдать местные нормы и правила
В целом, использование второго бутила требует строгого соблюдения мер безопасности. Работники, занимающиеся с этим веществом, должны быть обучены правилам безопасного обращения с ним и иметь доступ к необходимому оборудованию и средствам защиты. Безопасность должна быть приоритетом при работе с любым химическим веществом, включая второй бутил.
Реакции нуклеофильного замещения алкилгалогенидов
При действии на первичные алкилгалогениды различных полярных или ионных растворителей, содержащих неподеленные электронные пары, происходит замещение галогена. Эти реакции имеют ряд характеристик:
- Скорость реакции будет зависеть как от концентрации субстрата, так и нуклеофила (при соизмеримом соотношении количеств реагентов). В стадии, лимитирующей скорость всей реакции, участвуют и субстрат и нуклеофил.
- Энергия активации является относительно невысокой, поэтому образованию связи $C-Y$ не должен предшествовать разрыв связи $C-Hal$ в субстрате, для которого необходимы большие затраты энергии.
- Если в качестве субстрата брать один из энантиомеров алкилгалогенида, то при замещении в нем атома галогена нуклеофильным реагентом происходит обращение конфигурации. Нуклеофилу более выгодно атаковать молекулу субстрата со стороны, противоположной, замещаемому атому галогена.
Реакции нуклеофильного замещения для третичных алкилгалогенидов несколько отличаются от реакций первичных и вторичных алкилгалогенидов.
Пример 2
При действии на трет-алкилгалогениды солей азотистой кислотыобразуются не нитросоединения, а алкены и эфиры азотистой кислоты; при действии цианидов металлов – не нитрилы, а алкены и изонитрилы и т.д.
Атомы водорода метильных групп, связанные в алкилгалогениде с центральным атомом углерода, способны частично принимать на себя положительный заряд. Чем больше метильных групп связано с центральным атомом углерода, тем больше «распыляется» положительный заряд по периферийным атомам водорода, тем меньше сохраняется его на центральном атоме углерода и тем меньше притягивается к нему атом галогена.
Для третичных алкилгалогенидов гетеролиз молекулы с последующим образованием карбокатиона и галогенид-иона не требует большой затраты энергии, что подтверждается возрастанием дипольных моментов при увеличении числа метильных групп у центрального углеродного атома.
Пример 3
Гетеролиз метилбромида на ионы энергетически невыгоден, так как образуется богатый энергией карбокатион, в котором вероятность рассредоточения положительного заряда мала. Энергетически более выгодно образование трет-бутил-катиона, так как заряд может рассредоточиться на трех метильных группах, в состав которых входят девять атомов водорода.
Устойчивость карбокатионов и выгодность их образования возрастают в ряду:
$C^+ H_3$
Скорость гидролиза третичного алкилгалогенида зависит от его концентрации и не зависит от концентрации гидроксид-ионов в водных растворах. Реакции будут протекать с той же скоростью и при отсутствии щелочи.
В этих реакциях реализуется $SN1$-механизм. Реакция протекает в две стадии:
- гетеролиз алкилгалогенида с образованием карбокатиона; стадия медленная, лимитирует скорость всей реакции;
- карбокатион практически мгновенно взаимодействует с нуклеофильным реагентом или с растворителем.
Скорость реакции имеет нулевой порядок относительно нуклеофильного реагента и первый порядок относительно – алкилгалогенида.
Существование $SN1$-механизма подтверждено фактами:
- сравнительно высокие значения энергий активации, возникающие при гетеролитическом разрыве связей;
- независимость скорости реакции от концентрации нуклеофильного реагента;
- практически полная рацемизация.
Состав и характеристики
Структурно н-бутил и секбутил представляют собой одну и ту же группу, с той лишь разницей, что они связаны с R с разными атомами углерода. Н-бутил связывается с использованием первичного или первого углерода, а секбутил связывается со вторичным или вторым углеродом. В остальном они линейны и похожи.
Первые несколько раз secbutil вызывает путаницу, потому что его 2D-представление нелегко запомнить. Вместо того, чтобы пытаться представить его как привлекательную фигуру (крест, Y, нога или веер), просто знайте, что он точно такой же, как н-бутил, но связан вторым углеродом.
Таким образом, когда рассматривается любая структурная формула и принимается во внимание линейная бутильная цепь, можно сразу различать, является ли она н-бутилом или втор-бутилом. Втор-бутил немного менее объемный, чем н-бутил, поскольку его связь на 2-м атоме углерода не позволяет ему покрывать большее молекулярное пространство
Одним из следствий этого является то, что его взаимодействия с другой молекулой менее эффективны; поэтому ожидается, что соединение с втор-бутильной группой будет иметь более низкую температуру кипения, чем соединение с н-бутильной группой
Втор-бутил немного менее объемный, чем н-бутил, поскольку его связь на 2-м атоме углерода не позволяет ему покрывать большее молекулярное пространство. Одним из следствий этого является то, что его взаимодействия с другой молекулой менее эффективны; поэтому ожидается, что соединение с втор-бутильной группой будет иметь более низкую температуру кипения, чем соединение с н-бутильной группой.
В противном случае секбутил является гидрофобной, неполярной и ненасыщенной группой.
Применение
Анилин — это одно из первых органических соединений, полученных искусственным путём. Его открытие привело к созданию нескольких успешных отраслей.
В промышленности
Производственное использование анилина охватывает различные области — от получения ракетного топлива до изготовления крема для обуви.
Анилин и его соединения применяют в производстве:
- полиуретанов (конструкционные материалы, тепло- и звукоизоляция);
- ускорителей для вулканизации на основе натурального и синтетических каучуков (шины, резинотехнические изделия, резиновая обувь);
- красителей для тканей;
- эпоксидных полимеров;
- взрывчатых веществ;
- ингибиторов коррозии металлов;
- моторного топлива;
- смол, лаков.
Красители на основе анилина придают яркий цвет натуральным и синтетическим тканям, коже, шерсти, овчине. Однако существенным недостатком такого окрашивания является выгорание на солнце и низкая устойчивость к воздействию воды.
Анилин и его соединения являются сырьём для изготовления сложных промежуточных продуктов. Кроме основных областей применения, анилин используют при производстве гербицидов, пестицидов, фунгицидов, типографской краски, чернил, реактивов для фотографии, духов.
В медицине
Анилин является сырьём для фармакологической промышленности. Лекарства, изготовленные с его применением, оказывают следующее действие:
- обезболивающее, жаропонижающее — анальгин, бутадион;
- антимикробное — этазол, сульфален, сульгин, сульфаниламид, бисептол;
- нейролептическое — аминазин, пропазин.
Производные анилина входят в состав медицинских красителей. Метиленовый синий оказывает антисептическое, анальгезирующее действие. Генцианвиолет применяется как антибактериальное, противоглистное, местное противовоспалительное средство. Фуксин используют для местного лечения гнойничковых и грибковых заболеваний кожи, себореи. Красители применяют в бактериологических исследованиях для окраски микроорганизмов.
Тетраметилбутан — Справочник химика 21
Очевидно, эта реакция протекает настолько быстро, что трет—бутоксильный радикал не успевает разложиться с образованием трет-бутанола или ацетона. Третичный бутильный радикал, дис-пропорционируя, образует изобутан и изобутилен димери-зуясь, дает 2,2,3,3-тетраметилбутан, а при дальнейшей атаке продуктов реакции — триметилпентан и триметилпентен
Тетраметилбутан Дибутилсвый эфир Ди-втор-бутиловый эфир Ди-/прет-бутиловый эфир
Метод кристаллизации применяется для выделения из нефтяных фракций индивидуальных углеводородов или групп углеводородов (например, нормальных алканов), имеющих наиболее высокие температуры кристаллизации. Температура кристаллизаций зависит от размеров молекул и, в еще большей степени, от симметрии молекул углеводородов. Так, температура кристаллизации нормальных алканов повышается с увеличелием их молекулярной массы и, начиная с гептадекана (т. крист. 22,5 °С), это твердые вещества при комнатной температуре. Температуры кристаллизации трех изомеров октана, расположенных в порядке повышения молекулярной симметрии, приблизительно следующие 2-метил-гептан — 109 °С октан —-57°С 2,2,3,3-тетраметилбутан 101 °С, Температура кристаллизации п-ксилола (13,26 °С) на 38,5 °С выше, чем о-ксилола и на 61 °С выше, чем у наиболее близкокипя-щего ж-ксилола. «
Во всех трех реакци ях ориентировочно можно считать, что (Д529в)х.р 0, так как во всех трех процессах ДУх р=0. Следует указать, что энтропия весьма чувствительна к структуре, поэтому для заключения о величине Д5х.р не всегда можно ориентироваться только на знак и величину Д1 х,р. Так, например, в процессе изомеризации н-октана в 2, 2, 3, 3-тетраметилбутан ДУ1.р=0, но энтропия химической реакции не равна нулю Д5х.р 0, (Д5298)х.р= —18,5 э. е., Д5х.рупорядочивание структуры вещества сопровождается уменьшением энтропии.
ВОЗМОЖНЫХ изомеров, 2,2,3,3-тетраметилбутан является наиболее ста-бильным нз октавов с ДЯ бр, pasHofi —53.99 ккал/моль. Подобные тенденции наблюдаются и в других сериях изомеров.
свойства
-Структурная формула бутино (независимо от того, какой изомер упоминается) является C4H6, которая имеет линейную структуру.
-Одной из химических реакций, испытываемых молекулой бутина, является изомеризация, при которой внутри молекулы происходит перегруппировка и миграция тройной связи..
-1-бутин находится в газовой фазе, имеет очень высокую воспламеняемость и более высокую плотность, чем воздух.
-Это вещество также довольно реактивно, и в присутствии тепла может вызвать сильные взрывы.
-Кроме того, когда этот бесцветный газ испытывает неполную реакцию горения, это может вызвать угарный газ (СО)
-Когда оба изомера подвергаются воздействию высоких температур, они могут испытывать реакции полимеризации взрывного типа..
-2-бутин находится в жидкой фазе, хотя он также считается довольно легковоспламеняющимся при стандартных условиях давления и температуры.
-Эти вещества могут испытывать бурные реакции, когда они находятся в присутствии сильных окисляющих веществ..
-Точно так же экзотермические реакции с последующим выделением газообразного водорода происходят в присутствии восстанавливающих частиц..
-При контакте с определенными катализаторами (такими как некоторые кислотные вещества) или стартовыми веществами могут происходить реакции полимеризации экзотермического типа..
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
|
Bugarin et al. |
2010 |
Efficient, direct α-methylenation of carbonyls mediated by diisopropylammonium trifluoroacetate |
|
CN111171245B |
2022-08-02 | 保坍型聚羧酸减水剂用丙烯酸酯化合物的制备方法及应用 |
|
EP0452182B1 |
1994-08-03 | Procédé d'obtention d'au moins une oléfine tertiaire par décomposition de l'éther correspondant |
|
AU643339B2 |
1993-11-11 | Preparation of alkoxyalkanoic acids |
|
JPS58131930A |
1983-08-06 | アルカノ−ルアルコキシレ−トの製造法 |
|
CN108025997B |
2021-01-15 | 使用n-甲基-n-亚硝基化合物使烯烃类环丙烷化的方法 |
|
JPH0536428B2 |
1993-05-31 | |
|
CN111269115A |
2020-06-12 | 一种低共熔溶剂中肉桂酸酯的制备方法 |
|
RU2185368C2 |
2002-07-20 | Способ окисления ароматических соединений до гидроксиароматических соединений |
|
RU2149865C1 |
2000-05-27 | Способ получения моноалкиловых эфиров алкиленгликолей |
|
JP2017507899A |
2017-03-23 | バイオベースのアルキルおよびフラン系ジオールエーテル、アセタート、エーテル−アセタート、ならびにカーボナートの直接合成 |
|
US4507506A |
1985-03-26 | Alpha-olefin conversion |
|
CN111087417A |
2020-05-01 | 含有C-Si键的甲基二苯基硅烷类化合物的合成方法 |
|
JP2021512139A |
2021-05-13 | エステル交換条件下で反応性の基を有するエステル化合物の不均一触媒によるエステル交換 |
|
CN113956216A |
2022-01-21 | 一种环氧苯乙烷及其制备方法 |
|
CN112812001A |
2021-05-18 | 一种9,10-二羟基硬脂酸的制备方法 |
|
CN111978162A |
2020-11-24 | 一种芳香酮类化合物的合成新方法 |
|
CN105152931B |
2017-07-14 | 一种一步催化合成乙二醇甲醚苯甲酸酯的方法 |
|
CN1298382A |
2001-06-06 | 二甲基乙酰胺的制备方法 |
|
Jeon et al. |
2000 |
Radical reaction of phenylsulfonyl oxime ethers on solid support: application to the synthesis of α-amino esters |
|
JP2005247840A |
2005-09-15 | 1,3−プロパンジオールの製造方法及び該製造方法で得られる1,3−プロパンジオール |
|
JPH09249608A |
1997-09-22 | ビニルエーテルの製造法 |
|
CN116116402B |
2024-08-02 | 一种催化剂,其制备方法以及采用其催化甲醇和丙烯酸甲酯制备3-甲氧基丙酸甲酯的方法 |
|
US5239111A |
1993-08-24 | Propylene glycol monomethyl ether propionate compound and the process for the preparation thereof |
|
GB2271772A |
1994-04-27 | Propylene glycol monomethyl ether propionate |
1.3. АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ)
Ароматические углеводороды – производные бензола можно рассматривать как продукты замещения атомов водорода в бензоле одновалентными радикалами – алкильными, алкенильными, алкинильными. Первым представителем гомологического ряда аренов является бензол. Названия составляют из названий радикалов боковых цепей с добавлением окончания бензол. При составлении названия ароматического соединения за главную цепь принимают молекулу бензола.
Некоторые производные бензола имеют тривиальные названия (приведены в скобках), использование которых в заместительной номенклатуре в качестве родоначальных структур преимущественно:
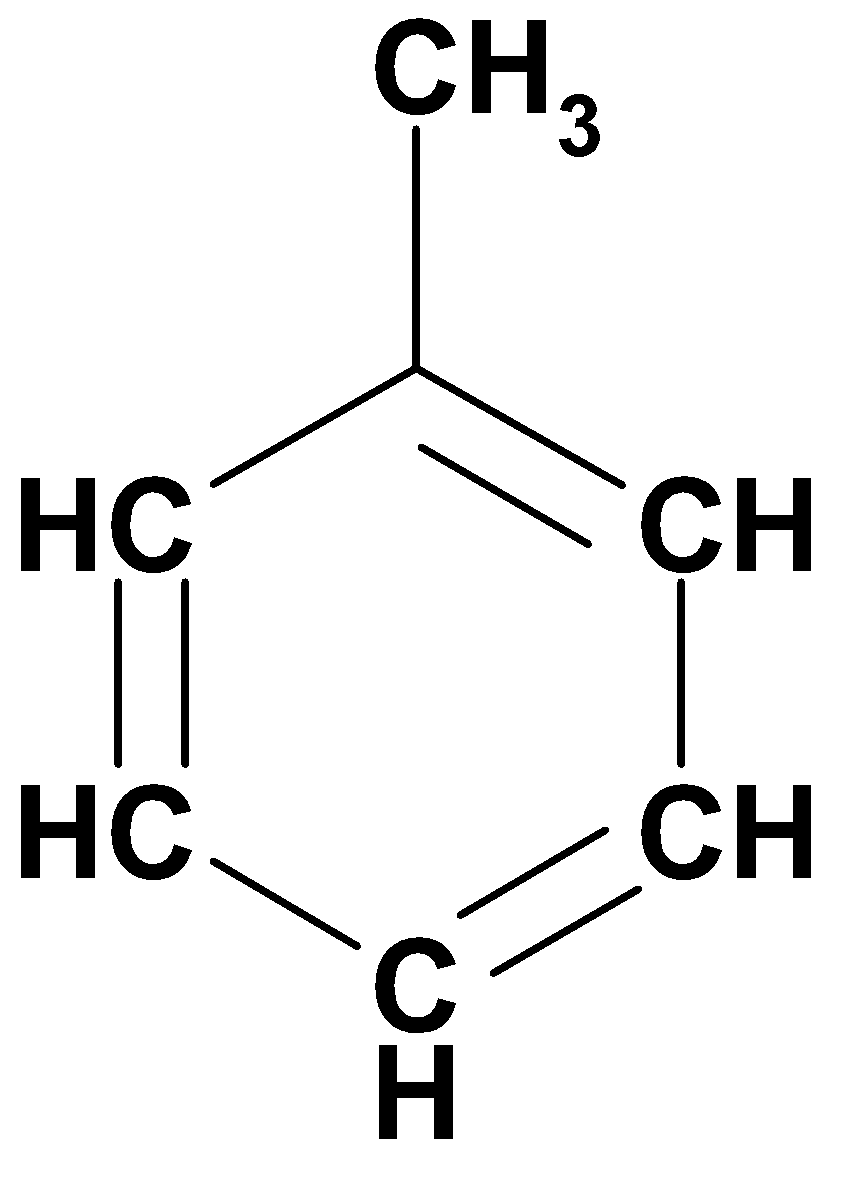 Метилбензол (толуол)
Метилбензол (толуол)
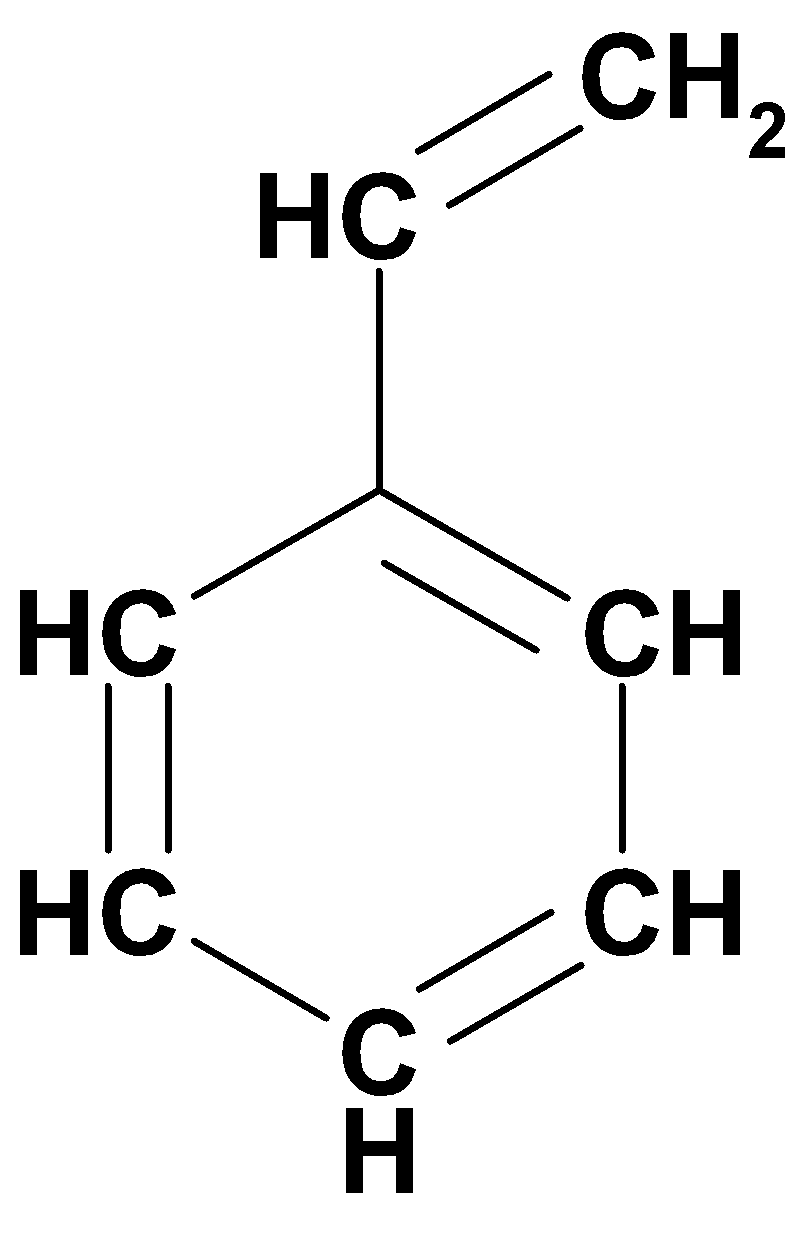 Винилбензол (стирол)
Винилбензол (стирол)
 Этинилбензол
Этинилбензол
 Изопропилбензол (кумол)
Изопропилбензол (кумол)
Если в ароматическом кольце несколько заместителей, то атомы углерода бензольного кольца нумеруются: в направлении, где больше заместителей, от самого главного заместителя (чем больше атомов углерода в радикале, тем он старше).
Для названия дизамещенных бензолов обычно используют приставки: орто– (1,2-положение), мета– (1,3-положение), пара– (1,4-положение), которые можно сокращать до первой буквы названия: о–, м–, п– соответственно.
2-этилтолуол (орто-этилтолуол)
1,3-диметилбензол (мета-диметилбензол)
4-метилкумол (пара-метилкумол)
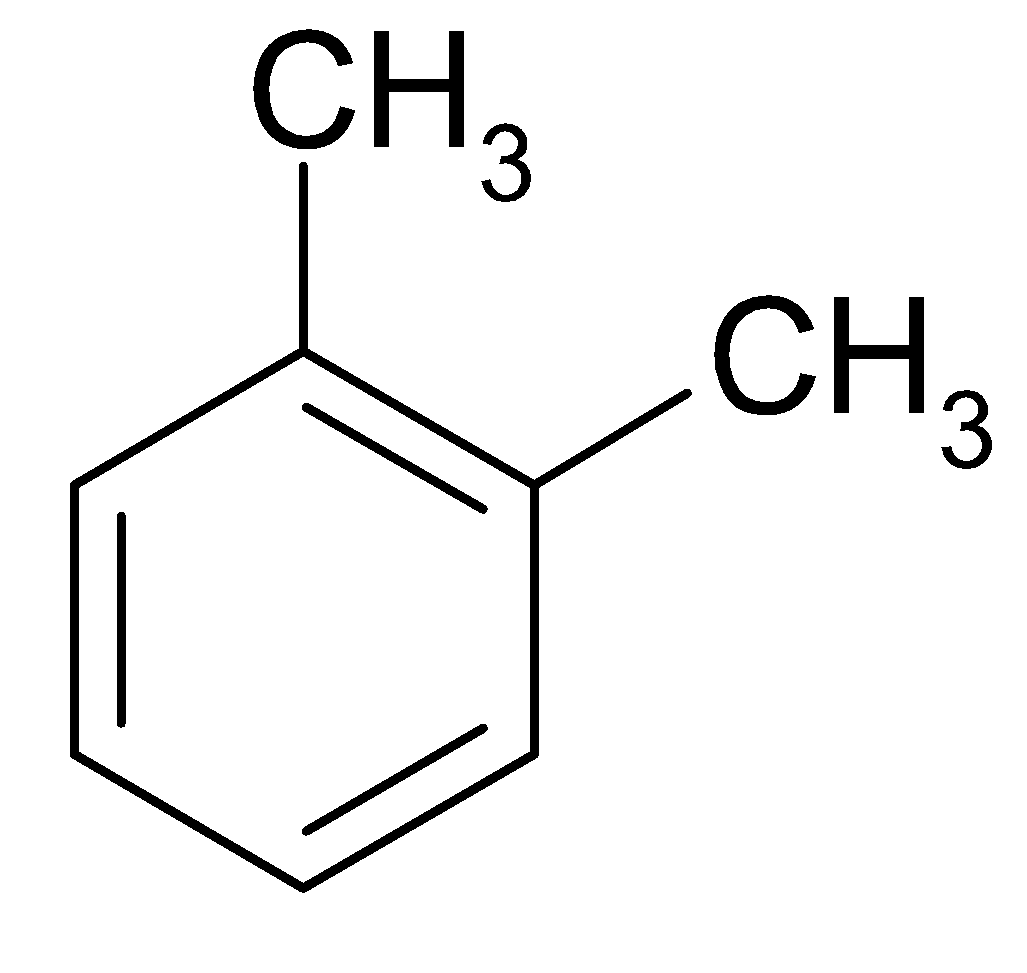 1,2-диметилбензол (орто-ксилол)
1,2-диметилбензол (орто-ксилол)
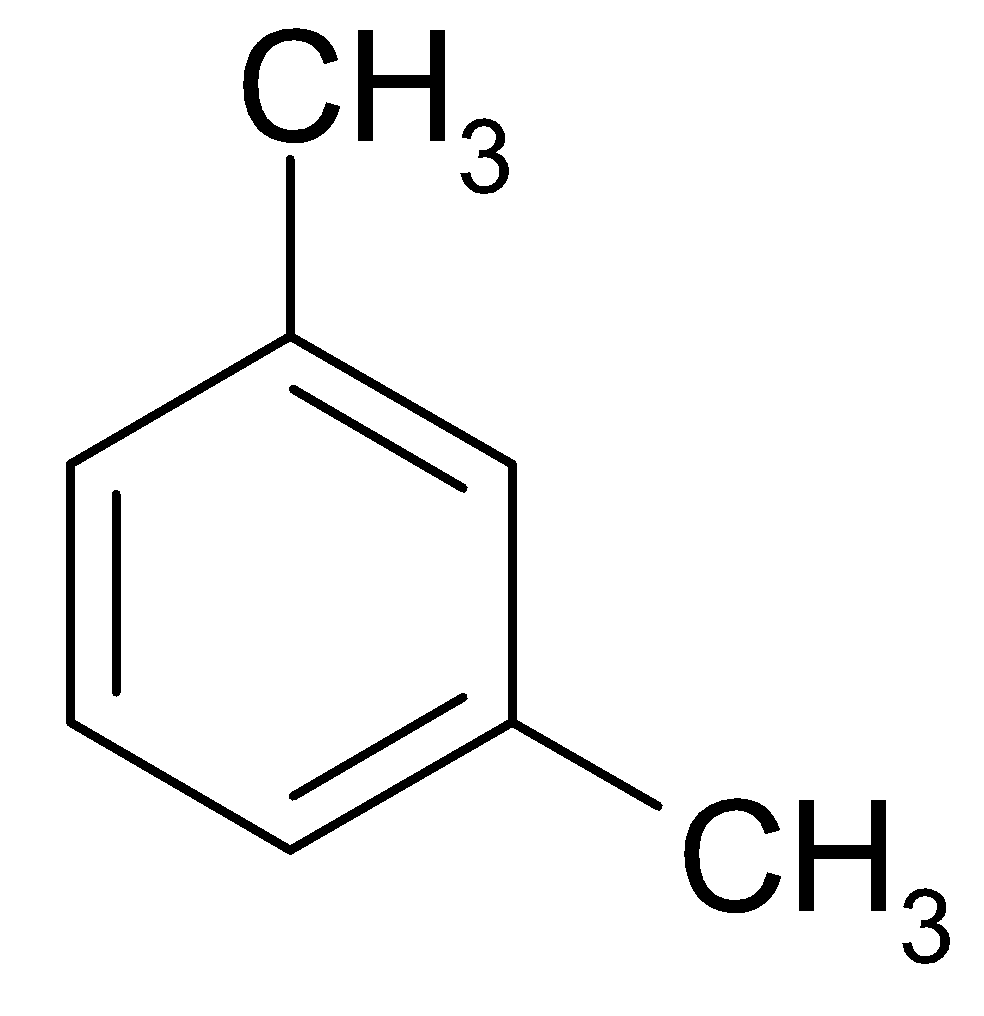 1,3-диметилбензол (мета-ксилол)
1,3-диметилбензол (мета-ксилол)
 1,4-диметилбензол (пара-ксилол)
1,4-диметилбензол (пара-ксилол)
Применение второго бутила
|
Производство пластмасс и синтетических каучуков Второй бутил широко применяется в качестве растворителя и промежуточного продукта в процессах производства пластмасс и синтетических каучуков. Он используется в реакционных средах для получения полимеров с заданными характеристиками и свойствами. |
Производство лакокрасочных материалов Второй бутил применяется в производстве лакокрасочных материалов в качестве растворителя для различных пигментов и смол. Он обладает хорошими растворяющими свойствами и способен эффективно выделять цвет и отделять глянцевые пленки. |
|
Нефтехимический комплекс Второй бутил используется в нефтехимическом комплексе в качестве растворителя для различных компонентов, таких как катализаторы и реагенты. Он также может использоваться для извлечения ценных химических соединений из сырой нефти или природного газа. |
Производство фармацевтических препаратов Второй бутил играет важную роль в производстве фармацевтических препаратов. Он может использоваться для извлечения активных компонентов из растений и других природных источников. Также он может служить растворителем для различных ингредиентов в процессе синтеза и формулирования лекарственных средств. |
|
Ароматизаторы и парфюмерия Второй бутил может использоваться в производстве ароматизаторов и парфюмерии в качестве основы или растворителя для различных ароматических компонентов. Он способен сохранять и передавать запахи и ароматы, что делает его важным компонентом в процессе создания парфюмерных продуктов. |
Научные исследования Второй бутил широко используется в химических исследованиях, где он может служить растворителем, индикатором или реагентом в различных экспериментах. Его специфические свойства и стабильность позволяют использовать его в различных химических реакциях и процессах. |
Таким образом, второй бутил является важным химическим веществом, находящим широкое применение в различных отраслях промышленности и научных исследований.
Втор-бутилацетат
|
Удельная активность микроорганизмов, катализирующих гидролиз. |
Изучение кинетики гидролиза втор-бутилацетата найденными микроорганизмами в течение 10 часов показало, что 10 штаммов сохранили достигнутый к 5 часам уровень конверсии, тогда как 4 штамма продолжают конвертировать субстрат дальше.
Бутиловый спирт идет на производство метилэтилкетона и втор-бутилацетата, применяется как растворитель нитратцеллюлозных лаков, как компонент гидротормозных жидкостей.
Вторичный бутиловый спирт идет на производство метил-этилкетона и втор-бутилацетата, применяется как растворитель нитроцеллюлозных лаков, а также как компонент гидротормозных жидкостей.
|
Удельная активность микроорганизмов, катализирующих гидролиз. |
Исследование способности найденных ферментных препаратов и клеток микроорганизмов трансформировать рацемический втор-бутилацетат и этил-3 — оксибутират в течение 5 часов позволило отобрать штаммы, гидролизующие эти соединения с конверсией близкой к 50 % уровню ( 14 и 11 штаммов, соответственно), что соответствует теоретически возможному выходу в процессах кинетического разделения рацемических смесей органических соединений.
С целью поиска оптимальных условий трансформации этил-3 — оксибутирата и втор-бутилацетата изучено влияние кислотности среды ( рН), температуры, начальной концентрации субстрата и сорастворителя на активность биокатализаторов.
Для получения препаративных количеств оптически активных этил-3 — оксибутирата, втор-бутилацетата, втор-бутанола и оксимасляной кислоты разработана принципиальная схема кинетического разделения рацемических смесей гидролизом эфиров в воде.
Созданы препаративные методы получения ( S) — () — втор-бутанола, ( К) — ( -) — втор-бутилацетата, ( ![]() — () — этил-3 — оксибутирата, ( R) — ( -) — этил-3 — оксибутирата, (
— () — этил-3 — оксибутирата, ( R) — ( -) — этил-3 — оксибутирата, ( ![]() — () — 3-оксимасляной кислоты, ( К) — ( -) — 3-оксимасляной кислоты, ( S) — () — глицидола и ( К) — ( -) — глицидола высокой оптической чистоты ( 96 — 100 % ее), которые являются ценными синтонами при получении различных низкомолекулярных биорегуляторов ( феромонов насекомых, ( 3-адренергетиков, цереброзидов, гормонов, простагландинов, нуклеозидов) и биоразлагаемых полимеров.
— () — 3-оксимасляной кислоты, ( К) — ( -) — 3-оксимасляной кислоты, ( S) — () — глицидола и ( К) — ( -) — глицидола высокой оптической чистоты ( 96 — 100 % ее), которые являются ценными синтонами при получении различных низкомолекулярных биорегуляторов ( феромонов насекомых, ( 3-адренергетиков, цереброзидов, гормонов, простагландинов, нуклеозидов) и биоразлагаемых полимеров.
Применение разработанной принципиальной схемы ( рис. 6) разделения рацемических эфиров органической фазе позволило получить ( К) — () — втор-бутилацетат с выходом 87 % ( от теоретически возможного при данной конверсии эфира) и оптической чистотой 99 % ее.
Объектами исследования являлись микроорганизмы, полученные на предыдущем этапе работы , клетки которых в стандартных условиях осуществляли стереоселективный гидролиз рацемических смесей втор-бутилацетата ( штамм 79 — 54), этил-3 — оксибутирата ( штамм 78 — 5), а также парциальное ацилирование гептанола-2 винилацетатом ( штаммы 77 — 47 и 77 — 33) с образованием энантиомерных соединений высокой оптической чистоты и выходом, близким к теоретическому.
Объектами биотрансформации являлись липолитические микроорганизмы синтезирующие внеклеточные или внутриклеточные липазы, выделенные из почвенных образцов, взятых с различных участков химических производств Республики Башкортостан и Сибири, а также втор-бутилацетат, этил-3 — оксибутират, глицидиловый эфир метакриловой кислоты и М — ЗЕ-пентен-2-ил-ортотолуидин ацетамид.
В результате сравнительного анализа принципиальных схем разделения в водной ( рис. 5) и в органической ( рис. 6) средах установлено, что получение оптически активных остаточных субстратов — втор-бутилацетата и этил-3 — оксибутирата предпочтительнее проводить в гексане вследствие меньшей трудоемкости и большей эффективности разделения.
Найдены оптимальные параметры энантиоселективного гидролиза ( температура 30 — 35 С; рН7 5 — 8 0; начальная концентрация субстрата 5 — 7 г / л; концентрация сорастворителя 30 — 35 % об. в зависимости от типа штамма) втор-бутилацетата и этил-3 — оксибутирата для полученных биокатализаторов.
|
Удельная активность микроорганизмов, катализирующих гидролиз. |
Понятие и химическая природа
Бутилкаучук является по своей химической природе сополимером изобутилена с изопреном, где последний имеет не очень большое процентное соотношение. Он имеет различные наименования, торговые марки и обозначения в разных странах мира, например БК (Россия), бюкар-бутил (США), EssoButyl (Великобритания), пластюжил-бутил (Франция) и т.д.
В общем виде химическую формулу БК можно представить в виде n-m (см. рис.1).

Рис.1 Формула бутилкаучука.
Молекулы бутилкаучука, в отличие от многих других видов синтетических каучуков, линейны. При этом положение изопреновых звеньев имеет статистический вид, т.е. не обладает выраженными закономерностями. Молекулярная масса БК равна от 200 до 700 тыс единиц.
Помимо собственно бутилкаучуков производят их следующие модификации: хлорбутилкаучуки и бромбутилкаучуки, структурированные бутилкаучуки, искусственные латексы.
Что такое бутиловый спирт
Фото автора cottonbro: Pexels
Бутиловый спирт хорошо растворяет вещества, которые не растворяются в воде, но отлично растворимы в жирах и масле. Сам бутилат, хоть и плоховато, но все же растворим в воде. Вода, в свою очередь, взаимно растворима в бутилате.
Кроме того, спирт делает гомогенными разные смеси, которые в его отсутствии обязательно разделились бы на два слоя: масло и воду. Это тот самый главный плюс, который делает его любимым в косметике компонентом. Минус – это резкий запах Butyl Alcohol, который многие не переносят.
Итак: бутиловый спирт – концентрированная, бесцветная жидкость, растворяющая смолы и воски. Она служит источником получения душистых компонентов: бутилацетата, бутилсалицилата, в шампунях гарантирует прочность состава, в лаках для ногтей работает растворителем.
Физические и химические свойства
Формула анилина — C6H5NH2 содержит аминогруппу, поэтому вещество имеет второе название — фениламин. А также благодаря присутствию бензольной группы, он известен как аминобензол.
По своим физическим свойствам анилин — это бесцветная маслянистая жидкость, малорастворимая в воде. Имеет неприятный аммиачный запах. При горении образует яркое коптящее пламя. Температура кипения анилина составляет 184,4 °C. Это горючее вещество — при нагревании выше 70 °C могут образоваться взрывоопасные соединения. На воздухе анилин легко окисляется и приобретает красно-бурый цвет.
Благодаря химическим свойствам взаимодействует с сильными неорганическими кислотами (соляная, серная, фосфорная) и образует соли.
Свойства анилина
https://youtube.com/watch?v=vX3xPqlf-9A
Спирты и фенолы
Спирты – производные углеводородов, один или несколько атомов водорода в которых заменены на гидроксильную группу -OH. Спирты с одной гидроксильной группой называют одноатомными, с двумя – двухатомными, с тремя трехатомными и т.д. Например:
Спирты с двумя и более гидроксильными группами называют также многоатомными спиртами. Общая формула предельных одноатомных спиртов CnH2n+1OH или CnH2n+2O. Общая формула предельных многоатомных спиртов CnH2n+2Ox , где x – атомность спирта.
Спирты могут быть и ароматическими. Например:
бензиловый спирт
Общая формула таких одноатомных ароматических спиртов CnH2n-6O.
Однако, следует четко понимать, что производные ароматических углеводородов, в которых на гидроксильные группы заменены один или несколько атомов водорода при ароматическом ядре не относятся к спиртам. Их относят к классу фенолы. Например, это данное соединение является спиртом:
А это представляет собой фенол:
Причина, по которой фенолы не относят к спиртам, кроется в их специфических химических свойствах, сильно отличающих их от спиртов. Как легко заметить, однотомные фенолы изомерны одноатомным ароматическим спиртам, т.е. тоже имеют общую молекулярную формулу CnH2n-6O.
Info
- Publication number
- RU2149865C1
RU2149865C1
RU99100939A
RU99100939A
RU2149865C1
RU 2149865 C1
RU2149865 C1
RU 2149865C1
RU 99100939 A
RU99100939 A
RU 99100939A
RU 99100939 A
RU99100939 A
RU 99100939A
RU 2149865 C1
RU2149865 C1
RU 2149865C1
Authority
RU
Russia
Prior art keywords
synthesis
organic compounds
monoalkyl esters
molybdenum
production
Prior art date
1999-01-12
Application number
RU99100939A
Other languages
English (en)
Inventor
А.А. Петухов
В.Ф. Швец
Ю.П. Сучков
Original Assignee
Индивидуальное частное предприятие «Вега-Хим»
Priority date (The priority date is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the date listed.)
1999-01-12
Filing date
1999-01-12
Publication date
2000-05-27
1999-01-12Application filed by Индивидуальное частное предприятие «Вега-Хим»
filed
Critical
Индивидуальное частное предприятие «Вега-Хим»
1999-01-12Priority to RU99100939A
priority
Critical
patent/RU2149865C1/ru
2000-05-27Application granted
granted
Critical
2000-05-27Publication of RU2149865C1
publication
Critical
patent/RU2149865C1/ru
Идентификация классического SN2-механизма и SN1-механизма, проходящего через контактную группу
Измерение относительной стабильности карбокатионов в суперкислых средах и газовой фазе показывает, что ионизация третичных алкильных субстратов должна протекать в $10^9-10^{12}$ раз быстрее, чем ионизация вторичных субстратов.
Пример 1
При сольволизе 2-адамантил- и 2-метил-2-адамантилбромидов в водном растворе этанола или в уксусной кислоте, скорость реакции будет в $10^8$ раз выше скорости сольволиза вторичного субстрата.
Вторичная 2-адамантильная система вступает в реакцию по $SN1$-механизму, проходящему через контактную группу. Стадия определяет скорость ионизации до ионной пары, которая включает 2-адамантильный катион. Этот катион не сольватирован по катионному центру нуклеофильным растворителем, хотя уходящая группа способна сольватироваться через образование водородной связи:
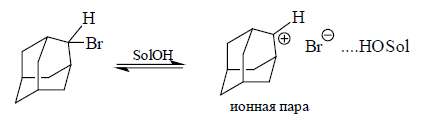
В $SN2$-реакцию азид-ион с 2-адамантильными субстратами не вступает, поэтому слабо нуклеофильные молекулы растворителя могут образовывать ионную пару в переходном состоянии.




























