Определение. Структура и формула основания

Основания (основные гидроксиды) – соединения, образуемые связью между положительно заряженным ионом металла и высокореакционной гидроксильной группой – анионом OH-. В зависимости от валентности металла его ион может присоединять одну или несколько гидроксогрупп.
В составе основания катион металла и протон H+, входящий в гидроксогруппу, взаимно отталкиваются. Их удерживает притяжение к отрицательному иону кислорода O2-, причем протон расположен ближе и притягивается сильнее. Связь с металлом менее прочна, и ее величина определяется радиусом металлического иона.
Общий вид формулы основного гидроксида — MeOHn. Для определения величины n – количества гидроксогрупп, присоединяющихся к металлу, необходимо знать его степень окисления :
| натрий Na+ | n=1 | NaOH |
| железо(II) Fe2+ | n=2 | FeOH2 |
| железо(III) Fe3+ | n=3 | FeOH3 |
В качестве основания может рассматриваться гидрат аммиака () в водном растворе, в этом случае формула данного соединения записывается как NH4OH.
Оксиды. Классификация, свойства, получение, применение
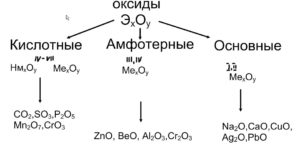
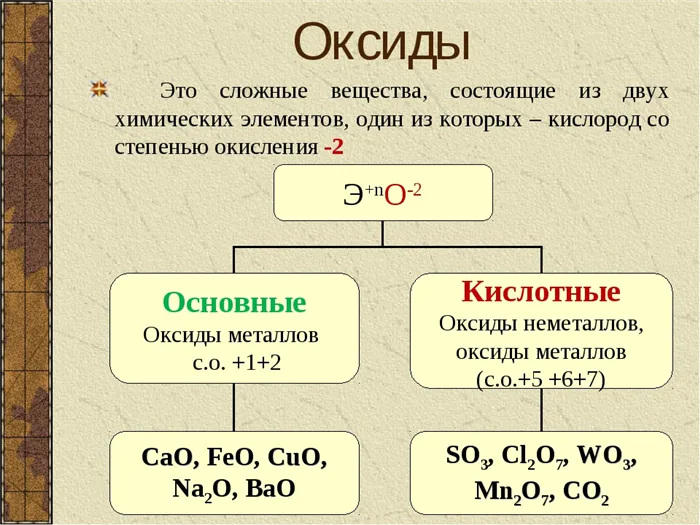
Оксиды — это неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2. Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
- Солеобразующие оксиды (CO2, N2O5,Na2O, SO3 и т. д.)
- Несолеобразующие оксиды(CO, N2O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
- Основные оксиды — (Оксиды металлов — Na2O, CaO, CuO и т д)
- Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn2O7,CO2, N2O5, SO2, SO3 и т д)
- Амфотерные оксиды (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты.
Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам:Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства:Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
CO2 – оксид углерода (IV)
N2O3 – оксид азота (III)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Химические свойства оксидов
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):Основные оксиды реагируют с кислотными оксидами с образованием солей:Аналогично реагируют и с кислотами, но с выделением воды:Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Кислотные оксиды в реакции с водой образуют кислоты:Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом: При обжиге или горении различных бинарных соединений:Термическое разложение солей, кислот и оснований :Взаимодействие некоторых металлов с водой:
Применение оксидов
Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид углерода CO2, который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
Классификация и наиболее важные свойства кислот и оснований
Несмотря на относительность понятий «кислота» и «основание», можно привести некоторые способы классификации, используемые для «типичных» К. и о., то есть для тех соединений, которые гл. обр. проявляют либо свойства кислоты, либо свойства основания. К.ио. подразделяют на неорганические (напр., азотная кислота, гидроксиды металлов, аммиак) и органические (карбоновые кислоты, амины). Неорганич. кислоты подразделяют на кислородсодержащие – оксокислоты (напр., серная кислота H2SO4) и бескислородные (напр., соляная кислота НСl). По числу отщепляющихся протонов различают кислоты одноосновные (напр., азотная кислота НNО3, уксусная кислота CH3СООН), двухосновные (угольная кислота Н2СO3, янтарная кислота HOOCCH2CH2COOH), многоосновные (фосфорная кислота Н3РО4, теллуровая кислота Н6TeО6); основания с одной или двумя гидроксильными группами называют соответственно одно- и двухкислотными, примеры – натрия гидроксид NaOH, кальция гидроксид Ca(OH)2. Каждой ступени диссоциации соответствует своя константа равновесия: константа кислотности Ka – для кислот (индекс a происходит от англ. acid), константа основности Kb – для оснований (индекс b – от англ. base). Вместо величин Ka и Kb используют соответствующие значения pK=–lgK. Кислоты можно разделить на очень сильные (pKa<0; серная кислота, значение pKa в разбавленных водных растворах ок. –2,8), сильные (0<pKa<4,5; фосфорная кислота, pKa ок. 2,1), средней силы (4,5< pKa< 9; уксусная кислота, pKa ок. 4,8), слабые (9<pKa<14; синильная кислота HCN, pKa ок. 9,2), очень слабые (pKa>14; вода, pKa ок. 15,7). Соответственно для классификации по силе оснований используют значения pKb (напр., для очень сильного основания NaOH pKb ок. –0,5, для сильного основания диэтиламина pKb ок. 3,0). Сила К.ио. зависит от природы растворителя, в котором осуществляется протолитич. равновесие. Для характеристики кислотности веществ, в т. ч. в неводных средах, используют кислотности функции. Наибольшую кислотность имеют сверхкислоты; наибольшую основность – сверхоснования.
Присутствием ионов Н+ в водных растворах кислот и ОН– в водных растворах оснований объясняется способность К. и о. изменять окраску индикаторов химических. Количественно кислотность растворов наиболее удобно оценивать с помощью водородного показателя pH; основность – по величине показателя pОН; взаимосвязь этих характеристик (pH+pОН=14) позволяет использовать для измерения кислотности и основности водных растворов единую шкалу. Для поддержания кислотности или основности на постоянном уровне используют кислотно-оснóвные буферные растворы.
Большинство кислот и органич. оснований хорошо растворимо в воде; большинство неорганич. оснований нерастворимо в воде. Растворимые в воде сильные неорганич. основания называют щелочами. Некоторые К. и о. существуют только в растворе (напр., ванадиевые кислоты). В водном растворе мн. кислородсодержащие кислоты являются сильными окислителями (оксокислоты – азотная HNO3, марганцовая HMnO4 и др., надкислоты – пероксодисерная H2S2O8 и др.), некоторые бескислородные кислоты – сильными восстановителями (иодоводородная кислота HI, сероводород H2S). Главным в химич. поведении К. и о. является способность кислот реагировать с основаниями (нейтрализации реакции) с образованием солей.
Номенклатура
Согласно номенклатуре ИЮПАК, оксиды обозначаются словом «оксид», за которым в общем случае следует название химического элемента, например, Na2O — оксид натрия, Al2O3— Оксид алюминия. Если элемент имеет переменную степень окисления, в названии оксида указывается степень окисления в скобках сразу после названия (без пробела). Например, Cu2O — оксид меди (I), CuO — оксид меди (II), FeO — оксид железа (II), Fe2О3— оксид железа (III), Cl2O7— оксид хлора (VII).







Очень часто другие оксиды называют монооксид или монооксид, если оксид содержит только один атом кислорода, диоксид или диоксиген, если он содержит два, триоксид или триоксид, если он содержит три и т.д. Например: монооксид углерода CO, диоксид углерода CO2Триоксид серы SO3.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например, монооксид углерода CO, сернистый ангидрид SO3и т.д.
В начале XIX века и ранее тугоплавкие, почти нерастворимые в воде оксиды химики называли «землями».
Традиционная номенклатура
Оксиды с более низкой степенью окисления (субоксиды) иногда называли оксидом и субоксидом (например, оксид углерода (II), CO — оксид углерода; треххлористый углерод, C3O2— двуокись углерода; закись азота (I), N2O — монооксид азота; оксид меди (I), Cu2O — оксид меди).
Оксиды с более высокой степенью окисления (например, оксид железа (III), Fe2O3) называются оксидами по этой номенклатуре, а двойные оксиды (т.е. с разной степенью окисления) — оксид-оксидами (Fe3O4= FeO-Fe2O3— оксид железа, уран(VI)-диоран(V) оксид, U3O8— оксид урана).
Однако эта номенклатура не является единой, поэтому эти названия, вероятно, следует считать традиционными.
Слабая кислота: примеры и свойства
Слабая кислота — это химическое вещество, которое в водном растворе осуществляет лишь частичную диссоциацию, образуя водородные ионы (H+) и ионы соответствующей кислоты. В отличие от сильных кислот, слабые кислоты обычно имеют меньшую скорость реакции и меньшую концентрацию водородных ионов в растворе.
Примеры слабых кислот:
- Уксусная кислота (CH3COOH) — находится, например, в уксусе. Ее слабокислотные свойства объясняют, почему уксусная кислота не является опасной для человека при использовании в домашних условиях.
- Угольная кислота (H2CO3) — присутствует в угольной газировке и является примером слабой кислоты. Это объясняет, почему угольная газировка имеет легкую кислинку на вкус.
- Фосфорная кислота (H3PO4) — используется в пищевой промышленности в качестве регулятора кислотности и консерванта. Кислота имеет слабую степень диссоциации и не обладает агрессивными свойствами сильных кислот.
Свойства слабых кислот могут варьироваться в зависимости от их концентрации в растворе, среды, в которой они находятся, и ряда других факторов. Они могут проявлять слабые антибактериальные и антигрибковые свойства, а также использоваться в качестве регуляторов pH в различных отраслях промышленности.
Примеры свойств слабых кислот:
Свойство
Описание
Слабая диссоциация
Слабые кислоты диссоциируют только частично, образуя водородные ионы в невысокой концентрации.
Меньшая реакционная активность
Слабые кислоты обычно имеют меньшую скорость реакции и меньшую активность в сравнении с сильными кислотами.
Способность регулировать pH
Слабые кислоты используются в качестве регуляторов pH в различных промышленных процессах и в лабораториях.
Безопасность при использовании
Слабые кислоты обычно менее агрессивны и безопасны для использования по сравнению с сильными кислотами.
Знание свойств слабых кислот позволяет использовать их в различных областях, таких как пищевая промышленность, лабораторные исследования, медицина и другие.
Сложные соединения
Химические соединения, состоящие из нескольких элементов, называются сложными: например, NaOH — гидроксид натрия (щелочь), HCl — соляная кислота, CuO — оксид меди, NaCl — хлорид натрия (соль). Классификация неорганических соединений основывается на их свойствах. Отличают 4 класса неорганических соединений: оксиды, гидроксиды, кислоты и соли. Названия веществами даются по номенклатуре ИЮПАК:
- Оксиды по номенклатуре: значение названия заключается в том, что они имеют в своем составе кислород со степенью окисления -2.
- Гидроксиды по номенклатуре: названия соединениям, содержащих в своем составе группу OH, дается похожим образом, только вместо слова «оксид» употребляется «гидроксид».
Оксиды (основные, кислотные, амфотерные)
Это сложные соединения, в состав которых входит O (кислород). Это могут быть как соединения с металлами (CaO), так и с неметаллами (NO). Могут иметь 3 агрегатных состояния:
- Твердые (оксид кремния).
- Жидкие (оксид водорода).
- Газообразные (оксид углерода со степенью окисления +4).
Могут иметь различные цвета (черный, белый, оранжевый и др.).
Признаки кислотных:

- взаимодействуют с растворимыми основаниями (растворимость вещества можно посмотреть в таблице растворимости), образуя соли;
- реагируют с водой, образуя кислоты (исключение — оксид кремния);
- вступают в реакцию с основными оксидами, образуя соль;
- взаимодействуют с солями более летучих оксидов.
Признаки основных:
- реагируют с кислотами, образуя соль и воду;
- взаимодействуют с водой, в результате чего получается гидроксид;
- вступают в реакцию с кислотными оксидами.
Описывая свойства, нельзя забывать про один очень важный момент: помимо кислотных и основных оксидов, бывают амфотерные. Они проявляют все свойства (и кислотные, и основные). К таким соединениям относятся оксиды цинка, алюминия, железа со степенью окисления +3, хрома и бериллия.
Гидроксиды (основания)
Гидроксиды — сложные вещества, которые могут состоять из соединения металла и гидроксильной группы OH. Сильные основания называются щелочами.
Физические свойства:
- твердые вещества белого цвета;
- растворяются в воде (большинство);
- проводят тепло и электричество;
- растворы разъедают ткани, кожу, волокна.

Кислоты и их свойства
Кислотой называется соединение, включающее в себя водород и кислотный остаток. Они могут содержать кислород, а могут быть бескислородными (например, хлороводородная кислота). Огромный список кислот делится на группы по количеству водорода: одноосновные (бромоводородная, йодоводородная кислоты), двухосновные (серная, угольная кислоты) и трехосновные (ортофосфорная кислота).
Основные признаки:

- Несколько агрегатных состояний: газы (например, хлороводородная кислота), жидкости (серная кислота), твердые вещества (кремневая кислота).
- Кислые на вкус.
- Угольная и сернистая кислота существуют только в водных растворах.
- Не имеют запаха.
- Хорошо растворимы в воде (большинство).
- Разъедают животные и растительные ткани.
Химические свойства:
- взаимодействуют с металлами;
- реагируют с оксидами металлов;
- вступают в реакцию с гидроксидами металлов;
- взаимодействуют с солями.
Соли и их растворимость
Соли — это соединения, состоящие из катиона металла и аниона кислотного остатка. В зависимости от состава, различают кислые, средние и основные соли. В кислые соли входит ион водорода, в основные — группа OH.
Физические свойства:
- твердые вещества, большинство растворимы в воде;
- проводят электричество;
- окраска зависит от катионов, входящих в состав соли.
Химические свойства:
- реагируют с металлами;
- взаимодействуют со щелочами;
- вступают в реакцию с солями;
- реагируют с кислотами;
- разлагаются при нагревании.
Условия гидролиза
article>Ðалеко не вÑе ÑÐ¾ÐµÐ´Ð¸Ð½ÐµÐ½Ð¸Ñ ÑаÑпадаÑÑÑÑ, вÑÑÑÐ¿Ð°Ñ Ð² ÑеакÑÐ¸Ñ Ñ Ð¼Ð¾Ð»ÐµÐºÑлами водÑ. СейÑÐ°Ñ Ð¼Ñ Ð½Ð° пÑимеÑе Ñолей ÑаÑÑмоÑÑим, какие веÑеÑÑва подвеÑгаÑÑÑÑ Ð³Ð¸Ð´ÑолизÑ, а какие неÑ, и Ð¾Ñ Ñего ÑÑо завиÑиÑ.
ÐаÑнем Ñ Ñого, ÑÑо лÑÐ±Ð°Ñ ÑÐ¾Ð»Ñ Ð²ÐºÐ»ÑÑÐ°ÐµÑ Ð² ÑÐµÐ±Ñ ÑаÑÑÑ Ð³Ð¸Ð´ÑокÑида и ÑаÑÑÑ ÐºÐ¸ÑлоÑÑ. Ðа ÑаÑÑÑ Ð³Ð¸Ð´ÑокÑида оÑвеÑÐ°ÐµÑ ÐºÐ°Ñион меÑалла, а за киÑлоÑÑ â анион киÑлоÑного оÑÑаÑка.
ÐапÑимеÑ:
-
ÑÑлÑÑÐ°Ñ Ð¼ÐµÐ´Ð¸ CuSO4 ÑоÑÑÐ¾Ð¸Ñ Ð¸Ð· оÑÐ½Ð¾Ð²Ð°Ð½Ð¸Ñ Cu(ÐÐ)2 и киÑлоÑÑ H2SO4;
-
ÑлоÑид наÑÑÐ¸Ñ NaCl ÑоÑÑÐ¾Ð¸Ñ Ð¸Ð· оÑÐ½Ð¾Ð²Ð°Ð½Ð¸Ñ NaOH и киÑлоÑÑ HCl;
-
каÑÐ±Ð¾Ð½Ð°Ñ Ð½Ð°ÑÑÐ¸Ñ Na2CO3 ÑоÑÑÐ¾Ð¸Ñ Ð¸Ð· оÑÐ½Ð¾Ð²Ð°Ð½Ð¸Ñ NaOH и киÑлоÑÑ H2CO3.
Ржизни пеÑвÑм ÑазÑÑÑаеÑÑÑ Ñамое Ñлабое, и гидÑолиз в Ñимии дейÑÑвÑÐµÑ Ð¿Ð¾ ÑÐ¾Ð¼Ñ Ð¶Ðµ пÑинÑипÑ. Ð Ñоде ÑÑой ÑеакÑии ÑаÑпадаÑÑÑÑ Ð±Ð¾Ð»ÐµÐµ ÑлабÑе ÑÐ¾ÐµÐ´Ð¸Ð½ÐµÐ½Ð¸Ñ (оÑÐ½Ð¾Ð²Ð°Ð½Ð¸Ñ Ð¸Ð»Ð¸ киÑлоÑнÑе оÑÑаÑки). СлабÑй каÑион или ÑлабÑй анион вÑÑÑпаÑÑ Ð²Ð¾ взаимодейÑÑвие Ñ Ð¸Ð¾Ð½Ð°Ð¼Ð¸ Ð²Ð¾Ð´Ñ Ð¸ ÑвÑзÑваÑÑ Ð¾Ð´Ð¸Ð½ из Ð½Ð¸Ñ Ð¸Ð»Ð¸ оба. Ð ÑаÑÑвоÑе обÑазÑеÑÑÑ Ð¸Ð·Ð±ÑÑок ионов H+ или гидÑокÑилÑÐ½Ð°Ñ Ð³ÑÑппа OHâ .
Ðапоминаем!
Ðажное ÑÑловие гидÑолиза â налиÑие в ÑоÑÑаве Ñоли Ñлабого иона.
РзавиÑимоÑÑи Ð¾Ñ Ñого, какие Ñоли подвеÑгаÑÑÑÑ Ð³Ð¸Ð´ÑÐ¾Ð»Ð¸Ð·Ñ â Ñо ÑлабÑм оÑнованием или Ñлабой киÑлоÑой, в иÑоге Ð¼Ð¾Ð¶ÐµÑ Ð¿Ð¾Ð»ÑÑиÑÑÑÑ ÐºÐ¸ÑлаÑ, ÑелоÑÐ½Ð°Ñ Ð¸Ð»Ð¸ нейÑÑалÑÐ½Ð°Ñ ÑÑеда водного ÑаÑÑвоÑа.
Ð ÑÑо пÑоиÑÑодиÑ, еÑли ÑÐ¾Ð»Ñ ÑоÑÑÐ¾Ð¸Ñ Ð¸Ð· ÑилÑного оÑÐ½Ð¾Ð²Ð°Ð½Ð¸Ñ Ð¸ ÑилÑного киÑлоÑного оÑÑаÑка? ÐиÑего. Ð ÑÑом ÑлÑÑае ее ÑилÑнÑе каÑÐ¸Ð¾Ð½Ñ Ð¸ Ð°Ð½Ð¸Ð¾Ð½Ñ Ð½Ðµ взаимодейÑÑвÑÑÑ Ñ Ð¸Ð¾Ð½Ð°Ð¼Ð¸ водÑ. Ð¢Ð°ÐºÐ°Ñ ÑÐ¾Ð»Ñ Ð½Ðµ ÑаÑпадаеÑÑÑ, Ñо еÑÑÑ Ð½Ðµ подвеÑжена гидÑолизÑ.
|
СÑема ÑимиÑеÑкой ÑеакÑии гидÑолиза вÑглÑÐ´Ð¸Ñ Ñак: XY + HOH = XOH + HY Рданном ÑлÑÑае:
|
Оксиды и гидроксиды: свойства и классификация
Оксиды и гидроксиды являются классом неорганических соединений, которые имеют широкое применение в различных отраслях промышленности и науки. Эти соединения состоят из элементов, в основном металлов, и кислорода или гидроксильной группы.
Оксиды – это химические соединения, состоящие из металлического элемента и кислорода. Их можно разделить на два основных типа: основные и кислотные.
Основные оксиды – это соединения, в которых металлический элемент образует ион с положительным зарядом, а кислород образует ионы с отрицательными зарядами. Примеры основных оксидов включают оксид кальция (CaO), оксид натрия (Na2O) и оксид алюминия (Al2O3).
Кислотные оксиды – это соединения, в которых металлический элемент образует ионы с положительными зарядами, а кислород образует ион с отрицательным зарядом. Примеры кислотных оксидов включают оксид серы (SO2), оксид углерода (CO2) и оксид азота (NO2).
Важно отметить, что оксиды могут обладать и амфотерными свойствами, то есть они могут вести себя как основания и кислоты в различных реакциях. Гидроксиды – это химические соединения, состоящие из металлического элемента и гидроксильной группы (-OH)
Они обладают щелочной реакцией и широко используются в различных сферах промышленности и медицины
Гидроксиды – это химические соединения, состоящие из металлического элемента и гидроксильной группы (-OH). Они обладают щелочной реакцией и широко используются в различных сферах промышленности и медицины.
Гидроксиды можно классифицировать на основные и амфотерные. Основные гидроксиды – это соединения, в которых металлический элемент образует ион с положительным зарядом и связан с гидроксильной группой. Примеры основных гидроксидов включают гидроксид натрия (NaOH), гидроксид кальция (Ca(OH)2) и гидроксид магния (Mg(OH)2).
Амфотерные гидроксиды – это соединения, которые могут действовать как основания и кислоты, в зависимости от условий реакции. Примерами амфотерных гидроксидов являются алюминиевый гидроксид (Al(OH)3) и цинковый гидроксид (Zn(OH)2).
Таблица ниже демонстрирует классификацию оксидов и гидроксидов по типу и примеры:
| Тип | Примеры оксидов | Примеры гидроксидов |
|---|---|---|
| Основные | CaO (оксид кальция)Na2O (оксид натрия)Al2O3 (оксид алюминия) | NaOH (гидроксид натрия)Ca(OH)2 (гидроксид кальция)Mg(OH)2 (гидроксид магния) |
| Кислотные | SO2 (оксид серы)CO2 (оксид углерода)NO2 (оксид азота) | — |
| Амфотерные | Al2O3 (оксид алюминия)ZnO (оксид цинка) | Al(OH)3 (гидроксид алюминия)Zn(OH)2 (гидроксид цинка) |
Оксиды и гидроксиды являются важными классами неорганических соединений, которые обладают разнообразными свойствами и находят широкое применение во многих областях науки и технологии.
Классификация кислот и оснований
Кислоты
Сильные кислоты
Такие кислоты, которые полностью диссоциируют в воде, производя катионы водорода H+ и анионы.
Пример сильной кислоты — соляная кислота HCl:
Примеры сильных кислот: HCl, HBr, HF, HNO3, H2SO4, HClO4
Слабые кислоты
Растворяются в воде только частично, например, HF:
Сильную и слабую кислоту можно различить измеряя проводимость растворов: проводимость зависит от количества ионов,
чем сильнее кислота тем она более диссоциирована, поэтому чем сильнее кислота тем выше проводимость.
Основания
Основания — это вещества, содержащие гидроксильную группу (OH-) выделяющие ионы
OH- в водном растворе.
Сильные основания
Сильные основания полностью диссоциируют в воде:
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены,
щёлочноземельные металлы) группы.
Слабые основания
В обратимой реакции в присутствии воды образует ионы OH-:
Большинство слабых оснований — это анионы:
Реакции кислота-основание
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и
основания, результирующий раствор будет нейтральным.
Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства
основания:
Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
Соль
Соль — это ионное соединение образованное катионом отличным от H+ и анионом отличным от O2-.
В слабом водном растворе соли полностью диссоциируют.
Что бы определить кислотно-щелочные свойства раствора соли, необходимо определить, какие ионы присутствуют
в растворе и рассмотреть их свойства:
Нейтральные ионы, образованные из сильных кислот и оснований не влияют на pH: не отдают ионы ни H+
ни OH- в воде. Например, Cl-, NO-3, SO2-4,
Li+, Na+, K+.
Анионы образованные из слабых кислот проявляют щелочные свойства (F-, CH3COO-,
CO2-3), катионов с щелочными свойствами не существует.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного
основания, в основном состоят из:
- Смесь слабой кислоты, соответствующей соли и слабого основания
- Слабое основание, соответствующая соль и сильная кислота
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание
с соответствующей солью, при этом необходимо учесть:
- Интервал pH в котором буфферный раствор будет эффективен
-
Ёмкость раствора — количество сильной кислоты или сильного основания, которые можно добавить не повлияв
на pH раствора - Не должно происходить нежелаемых реакций, которые могут изменить состав раствор
Классификация оксидов и гидроксидов по составу и структуре
Оксиды и гидроксиды – это химические соединения, состоящие из атомов кислорода (О) и элемента, с которым он соединяется. Они имеют различные составы и структуры, которые позволяют классифицировать их в соответствии с определенными характеристиками.
Классификация оксидов
Оксиды могут быть металлическими и неметаллическими в зависимости от свойств элемента, с которым они соединяются.
Металлические оксиды – это соединения, в которых кислород соединен с металлическими элементами. Они характеризуются тем, что кислород имеет отрицательный заряд, а металл – положительный. Примерами металлических оксидов являются оксид железа (Fe2O3), оксид алюминия (Al2O3) и оксид кальция (CaO).
Неметаллические оксиды – это соединения, в которых кислород соединен с неметаллическими элементами. В отличие от металлических оксидов, неметаллические оксиды характеризуются тем, что кислород имеет положительный заряд, а неметалл – отрицательный. Неметаллические оксиды обычно образуют кислотные растворы, так как могут образовывать кислоты при взаимодействии с водой. Примерами неметаллических оксидов являются оксид углерода (CO2), оксид азота (NO2) и оксид серы (SO2).
Классификация гидроксидов
Гидроксиды – это соединения, состоящие из одного атома кислорода и одного атома водорода (OH). Они также могут классифицироваться в зависимости от ионов, которые образуются при их диссоциации в воде.
Металлические гидроксиды – это соединения, в которых гидроксильная группа (OH) соединена с металлическими ионами. Металлические гидроксиды характеризуются основными свойствами, так как входящие в их состав металлы обладают способностью образовывать основания. Примерами металлических гидроксидов являются гидроксид натрия (NaOH), гидроксид калия (KOH) и гидроксид кальция (Ca(OH)2).
Неметаллические гидроксиды образуются при соединении гидроксильной группы (OH) с неметаллическими ионами. Они обычно являются кислотами или основаниями в зависимости от свойств неметаллов. Примерами неметаллических гидроксидов являются гидроксид серы (HSO4) и гидроксид фосфора (H3PO4).
Заключение
Классификация оксидов и гидроксидов по составу и структуре позволяет систематизировать эти соединения в зависимости от их свойств и реакционной способности. Металлические оксиды и гидроксиды обладают определенными химическими характеристиками, отличающимися от неметаллических
Это важно для понимания и изучения реакций, в которых они участвуют



























