Свойства индивидуальных химических веществ
1. Физические свойства:
- Температура плавления и кипения;
- Плотность, объем и масса;
- Цвет, запах и вкус;
- Растворимость в различных растворителях;
- Форма и состояние при различных условиях.
2. Химические свойства:
- Реакции с различными веществами;
- Стойкость к окислению, коррозии или разложению;
- Способность к образованию соединений;
- Проводимость электричества и тепла при растворении в воде или других растворителях;
- Способность к катализу или ингибированию реакций.
3. Биологические свойства:
- Токсичность, канцерогенность, мутагенность и другие воздействия на организмы;
- Фитотоксичность (влияние на рост и развитие растений);
- Гигиенические и санитарные характеристики (содержание вредных примесей, возможность использования в пищевой и фармацевтической промышленности и т.д.).
4. Экологические свойства:
- Биологическая разлагаемость;
- Влияние на окружающую среду при производстве, транспортировке, использовании, утилизации и хранении;
- Мобильность и устойчивость в природных условиях.
Знакомство с химией
Когда мы слышим слово «химия», сразу представляем человека, окружённого колбами, пробирками, наполненными веществами всевозможных цветов. Он записывает непонятные символы, которые нам кажутся иероглифами. Перед нами встает вопрос: что это за наука, какие задачи изучает? Ответ достаточно прост, предмет химии – вещества.
Химия — наука о веществах, их свойствах и превращениях в другие вещества.
Как и каждая наука, химия имеет свою историю развития. Первые химические знания появились до нашей эры, в Древнем Египте. Египтяне обладали химической наукой, которую называли «Священным искусством». Некоторые рецепты приготовления парфюмерии и лекарственных препаратов используют и до сих пор. Наверняка вы слышали об алхимиках и философском камне, с помощью которого, можно превратить любой металл в золото.
В современном представлении термин «химия» можно услышать в нескольких интерпретациях: химия как наука, а также продукты химического производства (одним словом химия). Мы не представляем наше существование без химических веществ. Просыпаясь утром, идём умываться: мыло, зубная паста ждут нас в ванной комнате. Ароматный чай и хрустящие хлопья на завтрак. Одежда, обувь, школьные принадлежности и многое другое мы получаем благодаря химическим технологиям.
Но также можно сказать, что химия – это вред. Неоднократно слышали о кислотных дождях, о гибели морских жителей из-за нефтяных пятен, о нитратах в овощах и фруктах и т. д.
Химия тесно связана с человечеством, является неотъемлемой его частью. Чтобы не наносить вред нашей планете, необходимо применять химические знания и рационально использовать вещества.
Именно благодаря своей многогранности химия применяется в каждой области:
- Медицина: лекарственные препараты, вакцины, искусственные органы, косметические средства;
- Искусство: живопись, архитектура, фотографии, изготовление ювелирных изделий, ковка, литье;
- Сельское хозяйство: удобрение, средства для борьбы с вредителями;
- Криминалистика: опознание личности по ДНК, отпечаткам пальцев, определение состава ядовитых и взрывчатых веществ;
- Строительство: производство строительных материалов, обработка древесины;
- Металлургия: без металлов не существует ни одна отрасль. Металлы и сплавы окружают нас повсюду;
- В быту: средство бытовой химии, при приготовлении обеда также применяем химические знания;
- Пищевая промышленность: молочная, мясная продукция, соусы, кондитерские изделия и т. д.;
- Охрана окружающей среды. На данный момент остро стоит проблема охраны окружающей среды. Деятельность человека губительно действует на планету. Но с помощью химических знаний, которые базируются на свойствах веществ, учёные находят способы очистки воды, почвы, воздуха от вредных веществ.
 (Источник)
(Источник)
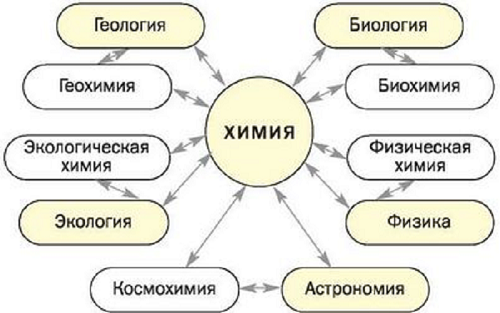
Химия – наука очень обширная и включает в себя много разделов, которые имеют своё назначение и изучают вещества, их строение и свойства.
- Неорганическая химия или её ещё называют химия неживой природы. Предмет изучения химические элементы и их соединения;
- Биохимия изучает процессы, которые происходят в организмах при обмене веществ, дыхании и т. д.;
- Органическая химия или химия углерода. Это увлекательный раздел знакомит о множестве соединений, благодаря уникальным свойствам углерода;
- Физическая химия рассматривает закономерности реакций;
- Аналитическая химия, благодаря качественному и количественному анализу позволяет исследовать смеси.
Чтобы овладеть химическими знаниями, необходимо изучить физику, биологию, а также математику. Как видно из схемы, химия тесно перекликается с другими науками.
Индивидуальное химическое вещество
Индивидуальные химические вещества принято делить на две группы: немногочисленную группу простых веществ ( их, учитывая различные аллотропные модификации, насчитывается около 500) и очень многочисленную группу сложных веществ.
Индивидуальные химические вещества принято делить на две группы: немногочисленную группу простых веществ ( их, с учетом аллотропных модификаций, насчитывается около 400) и очень многочисленную группу сложных веществ.
|
Определение фракционного состава нефтепродуктов. |
Перегонять индивидуальные химические вещества можно в любом аппарате, так как результаты перегонки определяются не конструкцией аппарата, а постоянной температурой кипения этих однородных жидкостей. При разгонке же нефтепродуктов, кипящих в широких температурных интервалах, конструкция аппарата и способ разгонки существенно влияют на результаты определения.
Перегонять индивидуальные химические вещества можно в любом аппарате, так как результаты перегонки определяются не конструкцией аппарата, а постоянной температурой кипения этих однородных жидко стей. При разгонке же нефтепродуктов, кипящих в широких температурных интервалах, конструкция аппарата и способ разгонки существенно влияют на результаты определения. Поэтому все нефтепродукты разгоняют в строго стандартных условиях в специальных аппаратах, видоизменяемых в зависимости от характера испытываемого нефтепродукта.
К индивидуальным химическим веществам не могут быть причислены ионы, хотя они и существуют в растворах в виде самостоятельно перемещающихся кинетически независимых частиц.
Компонентом называют индивидуальное химическое вещество, которое является составной частью системы, может быть выделено из нее и существовать самостоятельно.
Включает названия индивидуальных химических веществ, их групп и классов, а также принципы и правила составления этих названий. Часто названия конкретных соединений обусловлены особенностями языка и историческими традициями.
Включает названия индивидуальных химических веществ, их груш и классов, а также принципы и правила составления этих названий. Часто названия конкретных соединений обусловлены особенностями языка и историческими традициями.
Растворитель, представляющий собой индивидуальное химическое вещество или смесь веществ, исследуется в соответствии с обычными методами анализа органических соединений.
Многообразие подлежащих контролю индивидуальных химических веществ и их смесей, загрязняющих воздух, требует совершенствования организации гигиенического нормирования и создания средств контроля на основе современной аналитической техники. Наиболее прогрессивен автоматический анализ состояния воздушной среды, позволяющий непрерывно, надежно и с достаточной точностью определять концентрации вредных и взрывоопасных веществ в воздухе. Для этой цели предназначены автоматические газоанализаторы и сигнализаторы предельно допустимых и довзрывных концентраций химических веществ, применяемые как самостоятельно, так и в качестве датчиков в системах автоматического газового анализа, автоматической защиты и сигнализации.
Ионит не является индивидуальным химическим веществом, а представляет собой многокомпонентную систему, содержащую высокомолекулярные соединения с различными молекулярными весами; установить их точную химическую формулу, молекулярный вес и некоторые другие свойства пока затруднительно ввиду сложности структуры ионитов и отсутствия разработанных методов исследования.
Полимеры представляют собой не строго индивидуальные химические вещества, а смеси веществ несколько различающейся степени полимеризации ( так называемых полимеров-гомологов), так что практически можно говорить лишь о некоторой средней степени полимеризации. Так как различные полимеры-гомологи имеют различные температуры плавления ( чем выше степень полимеризации, тем выше и температура плавления), полимеры не имеют резко выраженной температуры плавления, которая свойственна низкомолекулярным веществам, а переходят из твердого состояния в жидкое при нагреве постепенно, на протяжении некоторого температурного интервала размягчения, поэтому для полимеров значение температуры размягчения ( см. § 5 — 3) определяют с помощью условных методов.
Экспериментально концентрационные пределы воспламенения индивидуальных химических веществ и смесей определяют на приборе КП ВНИИПО.
Указанные иониты не представляют собой индивидуальных химических веществ.
Отрасли науки и производства
Химическая промышленность — отрасль производства, связанная с применением химических реакций для создания новых веществ и материалов. В рамках этой отрасли производятся такие продукты, как пластмассы, красители, нефтехимические продукты, фармацевтические средства и т.д.
Материаловедение — наука, изучающая свойства материалов и способы их применения в технике. В процессе исследований в материаловедении учитываются общие свойства веществ, их структура и свойства в зависимости от различных факторов.
Экология — наука, изучающая отношения между живыми организмами и их окружающей средой. Она также занимается изучением воздействия промышленных процессов на окружающую среду и разработкой способов минимизации негативного влияния.
Фармацевтическая промышленность — отрасль, связанная с производством лекарственных средств для лечения различных заболеваний
В этой отрасли важно соблюдение высоких стандартов качества и безопасности при производстве препаратов
Энергетика — отрасль, связанная с производством, передачей и использованием энергии. В рамках этой отрасли производится электроэнергия, газ, нефть и другие источники энергии, которые затем используются в различных отраслях экономики.
Простое и сложное химическое вещество

Простые вещества
Простым называют вещество, состоящее из однотипных атомов, то есть образованное одним элементом. Его нельзя разложить на другие вещества.
Простые вещества подразделяют на две группы:
- металлы: натрий, алюминий, марганец, золото, железо и т. д.;
- неметаллы: кислород, озон, водород, хлор, графит и пр.
Если атомы связаны в молекулы, то простое вещество считается соединением (бром, фосфор, большинство газов). В отличие от них, металлы, алмаз, графит, инертные газы – это атомарные вещества.
Элемент и вещество
Понятие простого вещества необходимо отличать от понятия химического элемента. Элемент – это совокупность химически одинаковых атомов. В свободном виде он существует в форме природного или искусственного простого вещества.
| Химические элементы | Простые вещества | |
| Характеристики | Атомный номер
Распространенность Изотопный состав Валентность Химический символ |
Физические свойства (магнитные, оптические, термические и пр.)
Молярная масса Растворимость Токсичность Химическая формула |
| Примеры высказываний | Относительная атомная масса хлора равна 35,5
Азот входит в состав многих соединений |
Молекула хлора имеет относительную массу 71
Азот входит в состав атмосферы |
Аллотропия
Некоторые элементы в свободном виде существуют в нескольких формах. Это явление называется аллотропией. Различным формам одного элемента – аллотропным модификациям – присущи разные свойства. Аллотропия обусловлена следующими причинами:
- Различия в составе. Например, вещества кислород (O2) и озон (O3) – аллотропные модификации химического элемента кислород.
- Различия в строении. Элемент углерод представлен такими веществами, как алмаз, графит, графен, фуллерены. Различают аморфный и кристаллический кремний, белый, красный, черный и другие виды фосфора.

Число химических элементов достигло 118, но вследствие аллотропии простых веществ насчитывается свыше 400.
Сложные вещества
Сложное вещество построено из химически связанных атомов различных элементов. Получение и разложение сложных веществ осуществляется в химических реакциях. Это отличает их от смесей.
- Неметаллы, как правило, образуют вещества, состоящие из молекул: воду H2O, аммиак NH3, углекислый газ CO2, метан CH4.
- Металлы образуют немолекулярные соединения: поваренную соль NaCl, негашеную известь CaO, гидрид меди CuH.
Классификация сложных химических веществ
Исходя из строения и свойств, выделяют следующие классы сложных соединений:
- Бинарные. Это вещества, образованные двумя элементами: гидриды (CaH2, KH), карбиды (SiC, Mg2C) бескислородные кислоты (соляная HCl, сероводород H2S) и их соли (хлориды, сульфиды и др.).
- Оксиды. Это сложные бинарные вещества, в составе которых есть кислород со степенью окисления (условным зарядом иона) -2. Различают основные K2O, MgO (степень окисления металла +1, +2), кислотные SO3, CO2, CrO3 с неметаллами или металлами в степени окисления от +5 до +7, амфотерные ZnO, Al2O3 и несолеобразующие (CO, SiO, NO и N2O) оксиды.
- Гидроксиды характеризуются составом вида «элемент – группа OH». К этому классу веществ относят:
- Кислоты (азотная HNO3, фосфорная H3PO4, серная H2SO4). Образуются в результате взаимодействия кислотных оксидов с водой. Имеют в составе один или несколько атомов водорода, которые могут замещаться атомом металла, и кислотный остаток.
- Основания (едкий натр NaOH, гашеная известь Ca(OH)2), образующиеся в реакциях воды с основными оксидами. Растворимые основания (KOH, NaOH) называются щелочами.
- Амфотерные гидроксиды способны проявлять и кислотные, и основные свойства.
- Соли. Это сложные химические вещества с составом типа «металл – кислотный остаток». Соль – продукт реакции между кислотой и основанием. Карбонат калия (поташ) K2(CO)3, сульфат меди (медный купорос) CuSO4 – примеры солей.

| Наименования некоторых кислот, кислотных остатков и солей | |||||
| Кислота | Кислотный остаток | Соль | |||
| Азотная | HNO3 | нитрат | NO3 | нитрат натрия | NaNO3 |
| Азотистая | HNO2 | нитрит | NO2 | нитрит кальция | Ca(NO2)2 |
| Серная | H2SO4 | сульфат | SO4 | сульфат алюминия | Al2(SO4)3 |
| Сернистая | H2SO3 | сульфит | SO3 | сульфит калия | K2SO3 |
| Угольная | H2CO3 | карбонат | CO3 | карбонат кальция | CaCO3 |
| Хлорная | HClO4 | перхлорат | ClO4 | перхлорат серебра | AgClO4 |
| Хлорноватая | HClO3 | хлорат | ClO3 | хлорат меди | Cu(ClO3)2 |
| Кремниевая (метакремниевая) | H2SiO3 | силикат (метасиликат) | SiO3 | метасиликат лития | Li2SiO3 |
| Уксусная | CH3COOH | ацетат | CH3COO | ацетат натрия | CH3COONa |
| Марганцовая | HMnO4 | перманганат | MnO4 | перманганат калия | KMnO4 |
| Муравьиная | HCOOH | формиат | HCOO | формиат калия | HCOOK |
Количество сложных веществ, включая полученные искусственно соединения, превышает 25 миллионов.
Смеси
Смеси — это вещества, в состав которых входят элементы или соединения, не вступившие в химические реакции друг с другом. Это означает, что компоненты смеси перемешаны между собой, но не связаны химической связью, и их легко можно разделить. Например, перемешав металлические кнопки с осколками стекла, мы получим смесь. Для того чтобы извлечь из нее кнопки, нужно всего лишь поднести магнит, который притянет все металлические предметы. Несложно выделить чистый песок из смеси соли и песка. Для этого необходимо поместить смесь в воду, хорошо перемешать, дождаться полного растворения соли и отфильтровать раствор.
 Молоко — это смесь воды с мельчайшими частицами молочного жира, белка, минералов, витаминов и особого молочного сахара — лактозы
Молоко — это смесь воды с мельчайшими частицами молочного жира, белка, минералов, витаминов и особого молочного сахара — лактозы
А теперь давай посмотрим с точки зрения химии на тесто. Легко представить, что тесто — это тоже смесь, в состав которой входят различные «соединения»: мука, молоко, яйца, жиры, сахар и т.д.
Однако «смесью» тесто мы можем называть только до тех пор, пока оно не попало в духовку. Готовый пирог — это уже новое «соединение».

Чай с точки зрения химии
Обыкновенный чай, который ты пьешь, — это тоже пример смеси. И соотношение компонентов в ней может быть разным: кто-то любит покрепче и добавляет больше заварки, кто-то — послаще и кладет больше сахара, а кому-то нравится чай с лимоном или молоком. В каждом из этих случаев чай, или «смесь» с точки зрения химии, будет разным, несмотря на то что для его приготовления использовались одинаковые компонентов.
Глава IV. Органическая химия и общество.
§21. Биотехнология.
1. Что такое биотехнология? Почему её так называют?
Ответ:
Биотехнология – наука, изучающая использование живых организмов и биологических процессов в производстве.
В 1917 г венгерский учёный Карл Эреки ввёл термин «биотехнология» для обозначения производства необходимых обществу веществ с помощью живых микроорганизмов, используемых в качестве биореакторов.
2. Какие процессы относят к традиционным биотехнологиям?
Ответ:
Процессы относящиеся к традиционным биотехнологиям: хлебопечение (использование дрожжей в качестве разрыхлителя теста), виноделие (брожение виноградного сока вызывает особый грибок, живущий на кожице винограда), получения молочных продуктов, в том числе сыроварения (молочнокислые бактерии), и д. р.
3. Чем различаются аэробная и анаэробная очистка сточных вод?
Ответ:
Аэробная очистка сточных вод протекает в присутствии растворённого в воде кислорода, а анаэробная протекает без участия кислорода. Аэробная очистка необходима для окисления органические вещества, и для осаждения загрязняющих частиц. Анаэробная биологическая очистка эффективна при больших концентрациях загрязняющих веществ.
4. Что представляет собой генная инженерия?
Ответ:
Генная инженерия – это совокупность методов и технологий выделения генов из организма, введения их в другие организмы, а также конструирования новых, не существующих в природе генов.
5. Что такое клеточная инженерия? Каких успехов она достигла?
Ответ:
Клеточная инженерия – это методы конструирования клеток нового типа.
Благодаря клеточной инженерии, в настоящее время, выращивают микрорастения, их получают путём клонирования одной-единственной растительной клетки, такой посадочный материал генетически совершенно одинаков и не заражён вирусами. Также клоны клеток применяют как своеобразные химические заводы для получения биологически активных веществ: эритропоэтина, инсулина, средств для предотвращения тромбообразования в кровеносной системе.
6. Сравните биотехнологию и химическую технологию.
Ответ:
В основе химической технологии лежит создание новых материалов или усовершенствование уже известных с помощью химических законов, а в основе биотехнологии лежит использование живых организмов и биологических процессов в производстве.
Физические явления. Физические свойства веществ.
Явления, при которых вещества изменяют агрегатное состояние, но при этом не превращаются в другие вещества, называют физическими. Каждое индивидуальное вещество обладает определенными свойствами. Свойства веществ могут быть различными или сходными друг с другом. Каждое вещество описывают при помощи набора физических и химических свойств. Рассмотрим в качестве примера воду. Вода замерзает и превращается в лед при температуре 0°С, а закипает и превращается в пар при температуре +100°С. Данные явления относятся к физическим, так как вода не превратилась в другие вещества, происходит только изменение агрегатного состояния. Данные температуры замерзания и кипения – это физические свойства, характерные именно для воды.
Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
Испарение спирта, как и испарение воды – физические явления, вещества при этом изменяют агрегатное состояние. После проведения опыта можно убедиться, что спирт испаряется быстрее, чем вода – это физические свойства этих веществ.
К основным физическим свойствам веществ можно отнести следующие: агрегатное состояние, цвет, запах, растворимость в воде, плотность, температура кипения, температура плавления, теплопроводность, электропроводность. Такие физические свойства как цвет, запах, вкус, форма кристаллов, можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, например, в справочниках. Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна.
Газообразный кислород бесцветный, а жидкий – голубой Знание физических свойств помогает «узнавать» немало веществ. Например, медь – единственный металл красного цвета. Соленый вкус имеет только поваренная соль. Иод – почти черное твердое вещество, которое при нагревании превращается в фиолетовый пар. В большинстве случаев для определения вещества нужно рассматривать несколько его свойств. В качестве примера охарактеризуем физические свойства воды:
- цвет – бесцветная (в небольшом объеме)
- запах – без запаха
- агрегатное состояние – при обычных условиях жидкость
- плотность – 1 г/мл,
- температура кипения – +100°С
- температура плавления – 0°С
- теплопроводность – низкая
- электропроводность – чистая вода электричество не проводит
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
|
Соляная (хлороводородная) |
HCl | Хлорид | Cl(-) |
|
Плавиковая (фтороводородная) |
HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | H2S |
Сульфид Гидросульфид |
S(2-)HS(-) |
| Сернистая | H2SO3 |
Сульфит Гидросульфит |
SO3(2-)HSO3(-) |
| Серная | H2SO4 |
Сульфат Гидросульфат |
SO4(2-)HSO4(-) |
| Угольная | H2CO3 |
Карбонат Гидрокарбонат |
СО3(2-)НСО3(-) |
| Кремниевая | H2SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | H3PO4 |
Ортофосфат Гидроортофосфат Дигидроортофосфат |
РО4(3-)НРО4(2-)Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Что такое сложные вещества
Сложные вещества — это вещества, образованные атомами нескольких химических элементов.
Например, молекула HNO3 состоит из одного атома водорода, одного атома азота и трех атомов кислорода.
К сложным веществам в химии относятся две большие группы веществ: неорганические и органические.
Неорганические вещества
Неорганические вещества делятся на 4 вида:
-
Оксиды — вещества, молекулы которых состоят из двух химических элементов, один из которых — кислород в степени окисления −2.
Например: Na2O, CaO, P2O5.
-
Основания — вещества, молекулы которых состоят из катиона металла и гидроксильной группы (—OH).
Например: KOH, Fe(OH)3, Ni(OH)2.
-
Кислоты — вещества, молекулы которых состоят из катиона водорода (H+), способного замещаться атомом металла, и кислотного остатка.
Например: HNO3, HCl, H3PO4.
-
Соли — вещества, состоящие из катиона металла и кислотного остатка.
Например: NaCl, CaCO3, K2SO4.
Кратко о классификации веществ можно узнать из схемы:

Номенклатура неорганических веществ
Названия простых веществ чаще всего совпадают с названием химического элемента, а для сложных веществ существует два вида номенклатуры: тривиальная и систематическая.
В тривиальной номенклатуре вещества названы в соответствии с их особенностями, например специфическим запахом или окраской.
В систематической номенклатуре название зависит от вида неорганического вещества.
Оксиды
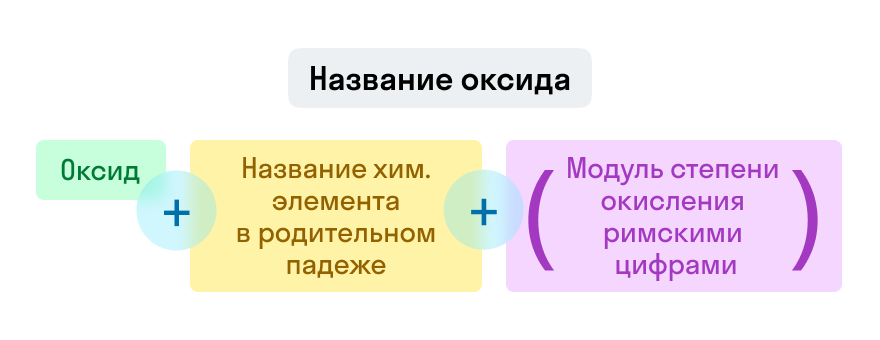
Напоминаем
Если степень окисления у элемента постоянная, то она в конце названия не указывается.
Примеры названий оксидов:
-
Fe2O3 — оксид железа (III). Читается: феррум два о три;
-
Na2O — оксид натрия. Читается: натрий два о.
Основания
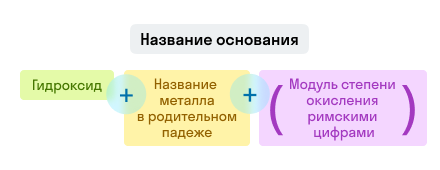
Примеры названий гидроксидов:
-
Fe(OH)3 — гидроксид железа (III). Читается: феррум о аш трижды;
-
NaOH — гидроксид натрия. Читается: натрий о аш.
Соли

Примеры названий солей:
-
KNO3 — нитрат калия. Читается: калий эн о три;
-
AlCl3 — хлорид алюминия. Читается: алюминий хлор три.
Кислоты




























