Физические свойства и применение
Дистиллированная вода обладает несколькими важными физическими свойствами, которые делают ее полезной в различных областях.
Во-первых, дистиллированная вода имеет очень низкое содержание минералов, солей и других примесей. Это делает ее идеальной для использования в батареях и охлаждающих системах, где присутствие минеральных отложений может повредить оборудование. Кроме того, ее чистота позволяет использовать дистиллированную воду в лабораториях для приготовления растворов и элементарных анализов, где неприродные примеси могут исказить результаты.
Во-вторых, дистиллированная вода обладает низкой температурой замерзания. По сравнению с обычной водой, дистиллированная вода начинает замерзать при более низких температурах. Это свойство делает дистиллированную воду полезной в промышленности и научных исследованиях, где требуется работать с очень низкими температурами. Например, дистиллированная вода используется в криогенной технике и воздушной разведке для охлаждения оборудования.
Применение дистиллированной воды:
1. Используется в качестве питьевой воды в районах с загрязненными источниками воды.
2. Применяется для создания лабораторных растворов в химических и биологических исследованиях.
Вода в литературе, искусстве и живописи
«Старик и море» из цикла «Восточные мотивы» 2016 год Андрей Кулагин
- 22 марта в мире отмечается Всемирный день воды;
- В художественной литературе мы встречаем произведения, связанные с водой. Поэты, писатели посвящают воде свои творения, делают воду героиней своих произведений;
- Вода часто олицетворяет человеческое начало: матушка, водица, реченька, студеная, ключевая — это все вода. Ей придаются сказочные, волшебные свойства. Герои в сказках выпивают водицы из лужи и перевоплощаются в животных;
- Мартынов Леонид «Вода»
- Эрнест Хемингуэй «Старик и море»
- Жуковский Василий «Море»
- Пушкин Александр Сергеевич «К морю»
- Некрасов Николай «На Волге»
- Жюль Верн «Двадцать тысяч лье под водой»
- Дэн Симмонс «Террор»
- Адамов Григорий «Тайна двух океанов»
- Александр Беляев «Человек-амфибия»
- Жюль Верн «Пятнадцатилетний капитан»
- Подвиги Геракла
Исследования воды[]
Гидрология
Основная статья: Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
Гидрогеология
Основная статья: Гидрогеология
Гидрогеоло́гия (от др.-греч. ὕδωρ «водность» + геология) — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой.
В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Гидрогеология тесно связана с гидрологией и геологией, в том числе и с инженерной геологией, метеорологией, геохимией, геофизикой и другими науками о Земле. Она опирается на данные математики, физики, химии и широко использует их методы исследования.
Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений.
Формула для расчета
Данный показатель повышается пропорционально погружению. Он рассчитывается по специальной формуле:
P = p * g * h, где
- p — плотность среды. Примерно равна 1000 кг/м2.
- g — это ускорение, которое придается телу силой тяжести. Это значение называется ускорением силы тяжести или свободного падения. На Земле данная величина примерно равняется 9,81 м/с2.
- h — глубина, на которую погружается какой-либо объект. Высчитывается в метрах.
Формула является выражением закона Паскаля. По ней высчитывается значение гидростатического прессинга. Он напрямую зависит от высоты водного столба.
Произведение плотности (p) и ускорения (g) приблизительно равняется 0,1 атм. С каждым метром опускания на дно воздействие в водной среде повышается на 0,1 атм. Данное правило подтверждает тот факт, что чем глубже происходит опускание в толщу, тем выше становится показатель воздействия.
Влияние глубины

Чем глубже погружение в толщу воды, тем больше становится ее прочность. Глубина напрямую влияет на увеличение давления. Это значение увеличивается пропорционально.
Чем он глубже, тем больше плотность водяного столба. С каждым последующим опусканием корпуса возникает возрастающая разница между внешним и внутренним давлением воды.
На поверхность действует атмосферное давление. При погружении в воду помимо нее начинают испытывать гидростатическое сжатие тела.
Даже на мелководье на тело действует совокупное воздействие, состоящее из атмосферного и гидростатического. Во время дайвинга внешнее воздействие на организм усиливается. Разница возникает из-за увеличения плотности среды.
Верхние слои давят на нижние. Это создает сжимающую силу в глубокой воде. К тому же его показатель на одинаковой глубине одинаков во всех направлениях.
Вода как символ чистоты
Чистота воды проявляется в ее способности очищать и омывать все, с чем она контактирует. Вода является универсальным очистителем и используется во множестве обрядов и религиозных обрядов. В христианстве, например, вода играет особую роль в крещении, олицетворяя очищение от грехов и новое рождение.
Вода также ассоциируется с прозрачностью и откровением. Как прозрачное вещество, вода может являться символом ясности мысли и понимания. Многие образы и пословицы связаны с этим символом — «просветиться», «положить все на чистую воду» и т.д.
Символика воды как чистоты присутствует не только в культурных и религиозных контекстах. В нашей повседневной жизни чистая вода считается признаком здорового образа жизни. Мы всегда стремимся пить чистую воду, чтобы сохранять свое здоровье и чистоту организма.
Вода как символ чистоты олицетворяет доброту, откровенность, ясность мысли и непорочность. Она напоминает нам о необходимости беречь и сохранять чистоту как внутри себя, так и в окружающей среде. Чистая вода — это не только физическое благополучие, но и состояние духовного равновесия.
Температура превращения в лед
Скорость превращения очищенной воды в лед зависит от условий, в которых она находится. Дистиллированная смесь снаружи и внутри автомобильного аккумулятора замерзает при разной температуре. В этих двух случаях температура замерзания разная.
На улице
Очищенный состав при внешних условиях довольно быстро кристаллизуется. На открытом воздухе нет факторов, препятствующих быстрому превращению раствора в лед.
Качественный дистиллят снаружи может замерзнуть при -10 0 C. Это значение и есть точка замерзания. Но часто имеющиеся в продаже составы превращаются в лед при температуре от -1 до -5 0 С.
Отчего горячая вода замерзает быстрее холодной?
Горячая вода замерзает быстрее, чем холодная: это явление заметил Эрасто Мпемба, ученик Танганьики. Его эксперименты с массой мороженого показали, что скорость замораживания нагретой массы намного выше, чем у холодной.
Одна из причин этого интересного явления, получившего название «парадокс Мпембы», — это большая теплопередача горячей жидкости, а также наличие в ней большего количества зародышей кристаллизации, чем в холодной воде.
Взаимосвязаны ли температура замерзания воды и высота?
При изменении давления, часто связанном с разной высотой, точка замерзания воды начинает кардинально отличаться от стандартной характеристики для обычных условий.
Кристаллизация воды на больших высотах происходит при следующих значениях температуры:
- как ни парадоксально, но на высоте 1000 м вода замерзает на 2 градуса Цельсия;
- на высоте 2000 метров это происходит уже при 4 градусах Цельсия.
Наивысшая точка замерзания воды в горах наблюдается на высоте более 5000 тысяч метров (например, в Фанских горах или на Памире).
Растворимость веществ в воде
- хорошо растворимые вещества — в 100 г воды растворяется более 1 г вещества при н.у.;
- малорастворимые вещества — в 100 г воды растворяется 0,01-1 г вещества;
- практически нерастворимые вещества — в 100 г водры растворяется менее 0,01 г вещества.
Совершенно нерастворимых веществ в природе не существует.
При растворении многих веществ в воде вокруг их молекул образуется оболочка из молекул воды — такой «слоеный пирог» называется гидратом. После кристаллизации в составе таких комплексов сохраняются некоторая часть молекул воды, образуя кристаллогидрат:
CuSO4+5H2O = CuSO4·5H2O
См. далее:
- Жесткость воды
- Пероксид водорода (H2O2)
Физические свойства воды при температуре от 0 до 100°С
В таблице представлены следующие физические свойства воды: плотность воды ρ, удельная энтальпия h, удельная теплоемкость Cp, теплопроводность воды λ, температуропроводность воды а, вязкость динамическая μ, вязкость кинематическая ν, коэффициент объемного теплового расширения β, коэффициент поверхностного натяжения σ, число Прандтля Pr. Физические свойства воды приведены в таблице при нормальном атмосферном давлении в интервале от 0 до 100°С.
Физические свойства воды существенно зависят от ее температуры. Наиболее сильно эта зависимость выражена у таких свойств, как удельная энтальпия и динамическая вязкость. При нагревании значение энтальпии воды значительно увеличивается, а вязкость существенно снижается. Другие физические свойства воды, например, коэффициент поверхностного натяжения, число Прандтля и плотность уменьшаются при росте ее температуры. К примеру, плотность воды при нормальных условиях (20°С) имеет значение 998,2 кг/м3, а при температуре кипения снижается до 958,4 кг/м3.
Такое свойство воды, как теплопроводность (или правильнее — коэффициент теплопроводности) при нагревании имеет тенденцию к увеличению. Теплопроводность воды при температуре кипения 100°С достигает значения 0,683 Вт/(м·град). Температуропроводность H2O также увеличивается при росте ее температуры.
Следует отметить нелинейное поведение кривой зависимости удельной теплоемкости этой жидкости от температуры. Ее значение снижается в интервале от 0 до 40°С, затем происходит постепенный рост теплоемкости до величины 4220 Дж/(кг·град) при 100°С.
| t, °С → | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| ρ, кг/м3 | 999,8 | 999,7 | 998,2 | 995,7 | 992,2 | 988 | 983,2 | 977,8 | 971,8 | 965,3 | 958,4 |
| h, кДж/кг | 42,04 | 83,91 | 125,7 | 167,5 | 209,3 | 251,1 | 293 | 335 | 377 | 419,1 | |
| Cp, Дж/(кг·град) | 4217 | 4191 | 4183 | 4174 | 4174 | 4181 | 4182 | 4187 | 4195 | 4208 | 4220 |
| λ, Вт/(м·град) | 0,569 | 0,574 | 0,599 | 0,618 | 0,635 | 0,648 | 0,659 | 0,668 | 0,674 | 0,68 | 0,683 |
| a·108, м2/с | 13,2 | 13,7 | 14,3 | 14,9 | 15,3 | 15,7 | 16 | 16,3 | 16,6 | 16,8 | 16,9 |
| μ·106, Па·с | 1788 | 1306 | 1004 | 801,5 | 653,3 | 549,4 | 469,9 | 406,1 | 355,1 | 314,9 | 282,5 |
| ν·106, м2/с | 1,789 | 1,306 | 1,006 | 0,805 | 0,659 | 0,556 | 0,478 | 0,415 | 0,365 | 0,326 | 0,295 |
| β·104, град-1 | -0,63 | 0,7 | 1,82 | 3,21 | 3,87 | 4,49 | 5,11 | 5,7 | 6,32 | 6,95 | 7,52 |
| σ·104, Н/м | 756,4 | 741,6 | 726,9 | 712,2 | 696,5 | 676,9 | 662,2 | 643,5 | 625,9 | 607,2 | 588,6 |
| Pr | 13,5 | 9,52 | 7,02 | 5,42 | 4,31 | 3,54 | 2,93 | 2,55 | 2,21 | 1,95 | 1,75 |
Примечание: Температуропроводность в таблице дана в степени 108 , вязкость в степени 106 и т. д. для других свойств. Размерность физических свойств воды выражена в единицах СИ.
Физические и химические свойства
Физические свойства воды определяются особенностями ее строения (молекулярная кристаллическая решетка) и способностью переходить из одного агрегатного состояния в другое в сравнительно небольшом интервале температур. При обычных условиях вода — жидкость с определенной степенью прозрачности. По химической природе она представляет собой оксид водорода. Ее полярная молекула имеет высокий дипольный момент 1,84 Д, что объясняется большой разностью электроотрицательностей атомов кислорода и водорода.
Для промышленных процессов, а также для использования в быту, важен такой параметр вещества, как удельная теплоемкость. обладает очень высоким значением этой характеристики, как в жидком, так и твердом состояниях.
Удельная теплота плавления льда равняется 333,25 кДж/кг(0оС), а парообразования — 2250 кДж/кг.
Вода является отличным растворителем, характеризуется высоким поверхностным натяжением.
В химических реакция вода образуется, например, при нейтрализации кислот щелочами:
Кроме того, может быть получена при реакции оксидов металлов с водородом:
Химические свойства воды
В химическом отношении вода является активным веществом. Являясь участником многих окислительно-восстановительных реакций, она может выступать как растворителем, так и окислителем. Рассмотрим, к примеру, уравнение:
Это уравнение реакции электролиза, в ходе которого под действием электрического тока вода распадается на молекулярный кислород и водород.
Помимо высокой высокой растворяющей способности, вода является амфолитом — электролитом, обладающим одновременно и кислотными и основными свойствами:
При этом частицы H+ (в растворе присутствуют в виде ) и OH- имеют противоположные заряды.
При комнатной температуре вода способна взаимодействовать с наиболее активными металлами, образовывая щелочи. В ходе такой реакции выделяется водород:
А вот реакция с межгалоидными соединениями (интергалогенидами) протекает при пониженных температурах:
В отличие от других галогенов, фтор окисляет воду до кислорода:
Соли, образованные слабыми кислотами и основаниями, в водных растворах подвергаются полному гидролизу (разложению водой):
С водой также вступают в реакции простые вещества металлы и неметаллы, обычно при повышенной температуре:
Непредельные углеводороды ряда алкенов вступают в реакцию гидратации (присоединения воды) в присутствии минеральных кислот. При этом образуются предельные одноатомные спирты:
Опыт — замерзание соленой воды
Чтобы заморозить соленую воду, наполните две формы чистой водой и очень соленой водой. Поместите формы в холод или морозильную камеру. Вы заметите, что чистая вода замерзает, а соленая вода замерзает только при очень низких температурах. Хотя вода обычно имеет наибольшую плотность при 4 градусах Цельсия, она замерзает при нуле градусов Цельсия.
 Пресная и соленая вода — начало опыта
Пресная и соленая вода — начало опыта Пресная и соленая вода — после замерзания. Пресная вода замерзла быстрее.
Пресная и соленая вода — после замерзания. Пресная вода замерзла быстрее.
Однако морской лед ведет себя иначе, чем пресноводный лед. По мере увеличения солености температура замерзания соленой воды снижается. Температура замерзания колеблется от -1,6 до -1,9 градусов по Цельсию при уровне солености от 30 до 35 частей на миллион.
Образование морского льда можно рассматривать как замерзание пресной воды, но соли вытесняются в ячейки морской воды внутри ледяной массы. Когда температура достигает точки замерзания, образуются кристаллы льда, которые покрывают незамерзшую воду.
Значение воды в природе
Вода выполняет целый ряд функций в природе. Во-первых, она служит средой обитания для многих видов животных и растений. Вода обеспечивает необходимое окружение для размножения, питания и выживания различных организмов.
Кроме того, вода играет важную роль в геологических процессах. Она является неотъемлемой частью гидрологического цикла, который поддерживает постоянное движение и перераспределение воды на Земле. Вода испаряется из поверхности океанов, осаждается в виде дождя или снега, проникает в почву и становится подземными водами, а затем возвращается в океаны и реки.
Кроме того, вода играет важную роль в питательных циклах в природных экосистемах. Она обеспечивает необходимые условия для фотосинтеза, поглощения питательных веществ и роста растений. Вода также служит средой обитания для многих вирусов и бактерий, которые играют роль в различных экологических процессах.
Таким образом, вода является неотъемлемой и важной частью природы. Она обеспечивает жизненно важную среду для разнообразных видов живых организмов и поддерживает гидрологический цикл, который является основой для многих геологических и экологических процессов на планете Земля
Молекулы воды требуют больше места
Причиной тому, что происходят эти процессы расширения и сжатия различных веществ, являются молекулы. Те из них, которые получают больше энергии (это происходит в теплом помещении), двигаются намного быстрее, чем молекулы, находящиеся в холодном помещении. Частицы, которые имеют большую энергию, сталкиваются намного активнее и чаще, им необходимо больше места для движения. Чтобы сдержать то давление, которое оказывают молекулы, материал начинает увеличиваться в размерах. Причем это происходит достаточно стремительно. Итак, вода при замерзании расширяется или сжимается? Почему это происходит?
Вода не подчиняется этим правилам. Если мы начинаем охлаждать воду до четырех градусов Цельсия, то она уменьшает свой объем. Но если температура продолжает падать, то вода вдруг начинает расширяться! Существует такое свойство, как аномалия плотности воды. Это свойство возникает при температуре в четыре градуса Цельсия.

Теперь, когда мы выяснили, расширяется или сжимается вода при замерзании, давайте узнаем, как вообще возникает эта аномалия. Причина таится в частицах, из которых она состоит. Молекула воды создана из двух атомов водорода и одного — кислорода. Формулу воды все знают еще с начальных классов. Атомы в этой молекуле притягивают электроны по-разному. У водорода создается положительный центр тяжести, а у кислорода, наоборот — отрицательный. Когда молекулы воды сталкиваются друг с другом, то атомы водорода одной молекулы переходят на атом кислорода совершенно другой молекулы. Этот феномен называется водородной связью.
Вода на планете
Значение воды на нашей планете неизмеримо, так как это не только одно из самых существенных, но и самых замечательных явлений. Вода играет важнейшую роль в возникновении и продолжении жизни на Земле, в химическом составе живых организмов, в формировании погоды и климата. Таким образом, вода является самым важным веществом для всех живых существ на планете.
Большая часть поверхности Земли покрыта водой, включая океаны, моря, озера, реки и лед. Примерно 96,5 % воды Земли находится в океанах, 1,7 % — в подземных запасах, еще 1,7 % — в ледяных шапках и ледниках Антарктиды и Гренландии, небольшая часть — в реках, озерах и болотах. Только 0,001% воды находится в облаках, которые образуются из льда и жидких частиц воды, взвешенных в атмосфере.
При нормальных условиях вода находится в жидком состоянии, но при температуре 0°С застывает в лед, а при 100°С закипает и превращается в водяной пар.
При создании температурной шкалы Цельсия температуры таяния льда и кипящей воды использовались для определения значений 0°C и 100°C соответственно.
Список литературы
- Arons, А. В. and С. F. Kientjler (1954). Vapor Pressure of Seasalt Solutions. Transactions of the American Geophysical Union 35 (5): 722—728.
- Bowditch (1966). Oceanography, Part 6 of American Practical Navigator, H. O. Publication No. 9—Part 6, U. S. Navy Hydrographic Office.
- Brahzt, J. T. (1968). Ocean Engineering. Wiley, New York.
- Handbook of Chemistry and Physics, C. D. Hodgman, Ed. (1958). Chemical Rubber Publishing Company, Cleveland.
- Handbook of Chemistry and Physics, 50th ed., R. C. Weast, Ed. (1969). Chemical Rubber Publishing Company, Cleveland.
- Handbook of Tables for Applied Engineering Science, R. E. Bolz and G. L. Tuve, Eds. (1970). Chemical Rubber Company, Cleveland.
- Hobaica, E. D. (1964). Buoyancy Systems for Deep Submergence Structures. Naval Engineers Journal 75 (5): 733—741.
- International Critical Tables of Numerical Data, Vol. 3 (1928). McGraw—Hill, New York.
- International Critical Tables of Numerical Data, Vol. 4 (1928). McGraw— Hill, New York.
- International Critical Tables of Numerical Data, Vol. 5 (1929). Mc.Graw*-Hill, New York.
- International Oceanographic Tables (1966). National Institute of Oceanography of Great Britain and UNESCO, London.
- King D. A. (1969). Basic Hydrodynamics, Section 2 in Handbook of Ocean-and Underwater Engineering, J. J. Myers, Ed. McGraw—Hill, New York.
- Mechanical Engineers’Handbook. L. S. Marks, Ed. (1941). Me Graw—Hill, New York.
- Mujake, Yasso (1939). Chemical Studies of the Western Pacific Ocean. IV. The Refractive Index of Seawater. Bulletin of the Chemical Society of Japan 14 (6); 239—242.
- Rawson, K. J. and E. C. Tupper (1968). Basic Ship Theory. American Elsevier, New York.
- Reid, George K. (1961). Ecology of Inland Waters and Estuaries. Reinhold,. New York.
- Semioli, W. J. and P. B. Schubert (1974). Conversion Tables for SI Metri-fication. Industrial Press, New York.
- Sverdrup, H. U., Martin W. Johnson, and Richard H. Fleming (1942). The-Oceans—Their Physics, Chemistry and General Biology. Prentice—Hall, Englewood Cliffs, N. J.
- Standard Methods for the Examination of Water and Wastewater, 13 th ed. (1971). American Public Health Association, Washington, D. C.
- Tsurikova, A. P. and V. L. Tsurikov (1971). On the Concept of «Salinity»-Oceanology 11 (2): 282—285.
- Wilson, K. G. and A. B. Arons (1955). Osmotic Pressures of Seawater Solutions Computed from Experimental Vapor Pressure Lowering. Journal of Marine Science 14(2): 195—198.
Важное свойство воды
Одно из наиболее важных свойств воды — ее способность быть универсальным растворителем. Благодаря своей поларности и способности образовывать водородные связи, вода способна растворять множество химических веществ, что позволяет организмам получать необходимые питательные вещества из окружающей среды. Кроме того, вода является необходимым компонентом многих биологических реакций, так как она служит средой для протекания метаболических процессов.
Вода также обладает высокой теплоемкостью, что позволяет ей накапливать большое количество тепла без значительного изменения температуры. Благодаря этому свойству, вода является идеальным регулятором температуры в организмах, позволяя им поддерживать постоянную внутреннюю температуру в изменяющихся условиях окружающей среды.
Также следует отметить, что вода обладает высокой поверхностной натяжностью, что позволяет ей образовывать плёнку на поверхности и создавать капиллярные эффекты. Это свойство играет важную роль в транспорте воды и питательных веществ в растениях и животных.
Еще одно уникальное свойство воды — ее способность менять свое агрегатное состояние при относительно небольших изменениях температуры, что является основой для существования водных экосистем и поддержания жизни на планете Земля.
Таблица
Свойство
Описание
Универсальность растворителя
Вода способна растворять множество химических веществ и служит средой для метаболических процессов.
Высокая теплоемкость
Вода накапливает большое количество тепла без значительного изменения температуры, что позволяет организмам поддерживать стабильную температуру.
Поверхностная натяжность
Вода образует плёнку на поверхности и создает капиллярные эффекты, что важно для транспорта воды и питательных веществ в организмах.
Изменение агрегатного состояния
Вода может переходить из жидкого в газообразное и твердое состояние, что является базовым для существования водных экосистем.
Применение
- В земледелии
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90 % в некоторых странах.
- Для питья и приготовления пищи
Живое человеческое тело содержит от 50 % до 75 % воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья.
- Как растворитель
Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
- В качестве теплоносителя
Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в виде льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
- Как замедлитель
Во многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции. Также существуют тяжеловодные реакторы, в которых в качестве замедлителя используется тяжёлая вода.
- Для пожаротушения
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены, так как горение поддерживается только при достаточном поступлении кислорода.
- В спорте
Многими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это подводное плавание, хоккей, лодочные виды спорта, биатлон, шорт-трек и др.
- В качестве инструмента
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
- Для смазки
Вода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках.
Особенности воды[]
Интересной особенностью воды является то, что при нагревании от 0 до 4 (3,98 — точно) °C вода сжимается. Благодаря этому могут жить рыбы: когда температура падает ниже 4 °C, более холодная вода, как менее плотная, остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура.
У воды есть и другие особенности: высокая температура и удельная теплота плавления и кипения (по сравнению с соединениями водорода с похожим молекулярным весом); высокая теплоёмкость и низкая вязкость жидкой воды; вода, в отличие от других веществ, при замерзании расширяется. Вода практически несжимаема.
Все эти особенности обусловлены водородными связями. Поскольку в молекуле воды 2 атома водорода отдают по одному электрону атому кислорода, атом кислорода получает отрицательный заряд, а атомы водорода — положительный. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода — каждый в одной, а атом кислорода — в двух. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4 °С этот эффект слабее, чем обычное тепловое расширение; при испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Капля, ударяющаяся о поверхность воды
По сходным причинам вода является хорошим растворителем. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягиваются к атомам водорода, а отрицательно заряженные — к атомам кислорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворимого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде.[источник?] Поэтому вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Чистая вода была бы хорошим изолятором. Но благодаря тому, что вода — растворитель, в ней практически всегда растворены те или иные соли, что обуславливает наличие в воде различных положительных и отрицательных ионов, благодаря чему она проводит электрический ток. При температуре 647 K (374 °C или 705 °F) и давлении 22.064 MПa (3200 PSIA или 218атм) вода проходит критическую точку и не может оставаться в жидком состоянии.
Вода — основа жизни
Все живые существа на 75 % состоят из воды. Это самый необходимый элемент живой природы. Вода постоянно совершает круговорот между морями, атмосферой и сушей, создавая условия, в которых может существовать и развиваться жизнь.
Вода — на первый взгляд простейшее химическое соединение — является основой жизни на Земле. Вода транспортирует тепло, растворяет и переносит колоссальные массы химических веществ и элементов, разрушает и перераспределяет горные породы, образует формы рельефа и даже участвует в образовании полезных ископаемых. Кроме того, вода задействована в ряде метеорологических явлений, таких как осадки, туманы, облака. Она участвует в создании течений, волнений, перемещении русел рек и формировании водоемов. А еще она является средой жизни для множества организмов.
Под лучами Солнца вода испаряется из водоемов и поднимается в воздух. Там капельки воды собираются в облака и тучи и выпадают на землю в виде дождя или снега, который превращается в воду. Она впитывается в землю и снова возвращается в моря, реки и озера. И все начинается сначала. Так происходит круговорот воды в природе.
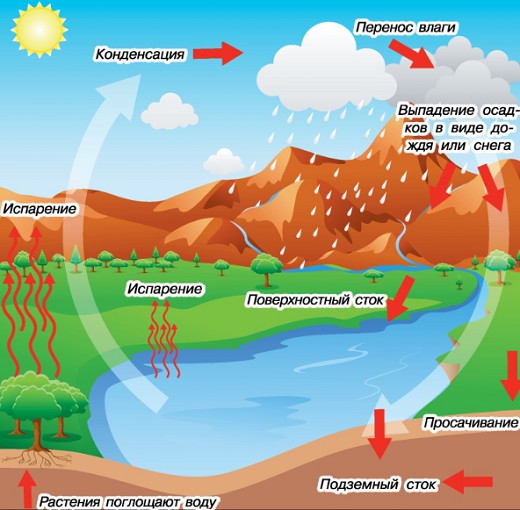 Круговорот воды в природе
Круговорот воды в природе
Биологическая роль
Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений.
Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить. Существует и другая точка зрения: если бы вода не расширялась при замерзании, то не разрушались бы клеточные структуры, соответственно замораживание не наносило бы ущерба живым организмам. Некоторые существа (тритоны) переносят замораживание/оттаивание — считается что этому способствует особый состав клеточной плазмы, не расширяющейся при замораживании.
Интересный феномен
Горячая вода замерзает быстрее холодной. Если мы возьмем два одинаковых стакана и нальем в один горячей воды, а в другой столько же холодной, то мы заметим, что горячая вода замерзнет быстрее, чем холодная. Это не логично, согласитесь? Горячей воде нужно остыть, чтобы начинать замерзать, а холодной этого не нужно. Как объяснить данный факт? Ученые по сей день не могут объяснить эту загадку. Данный феномен имеет название «Эффект Мпембы». Открыт был в 1963 году ученым из Танзании при необычном стечении обстоятельств. Студент хотел сделать себе мороженое и заметил, что горячая вода замерзает быстрее. Об этом он поделился со своим учителем физики, который сначала не поверил ему.





























