Значимость процесса прокаливания на воздухе в химии
Прокаливание на воздухе применяется для очистки металлов, сплавов и керамических материалов от примесей, оксидов и других загрязнений. В результате прокаливания, происходит окисление веществ, которые в последствии превращаются в газы или твердый шлак, который можно удалить механическим путем. Таким образом, материалы становятся более чистыми и пригодными для дальнейшего использования в производственных процессах.
Важно отметить, что процесс прокаливания на воздухе может быть опасным и требует соблюдения особых мер предосторожности. При нагревании определенных материалов может выделяться ядовитые газы или происходить взрыв. Поэтому, при проведении прокаливания необходимо соблюдать правила безопасности, работать в хорошо проветриваемых помещениях и использовать специализированное оборудование
Поэтому, при проведении прокаливания необходимо соблюдать правила безопасности, работать в хорошо проветриваемых помещениях и использовать специализированное оборудование.
Прокаливание на воздухе является одной из важных операций в химической промышленности, металлургии и научных исследованиях. Благодаря этому процессу, можно достичь высокой степени очистки материалов, повысить их качество и улучшить характеристики конечного продукта.
Функции и значение подслоя в химических реакциях
В химических реакциях подслой – это слой вещества, который образуется на поверхности реагирующих веществ при их взаимодействии. Подслой играет важную роль в протекании химических реакций и влияет на их скорость и эффективность.
Основные функции подслоя в химических реакциях:
Увеличение площади взаимодействия: Подслой, образующийся на поверхности реагирующих веществ, увеличивает их поверхность, что обеспечивает большую площадь контакта между реактивами. Это способствует более интенсивному взаимодействию молекул и повышает скорость реакции.
Снижение энергии активации: Подслой может снизить энергию активации химической реакции – минимальную энергию, необходимую для начала реакции. Это происходит благодаря формированию своеобразного «канала» для перемещения молекул реагентов, что позволяет им преодолевать барьер энергии активации.
Повышение растворимости: Подслой может улучшить взаимодействие растворителя с реагентами и повысить их растворимость
Это особенно важно в реакциях, где один из реагентов плохо растворим в другом.
Предотвращение нежелательных побочных реакций: Подслой может предотвратить нежелательные побочные реакции, так как он может служить барьером для веществ, не участвующих в главной реакции или способных вызвать побочные эффекты.
Примеры подслоев в химических реакциях:
- Оксидные подслои: Во многих реакциях металлов с воздухом или водой на их поверхности образуются оксидные подслои. Эти подслои играют важную роль в защите металла от коррозии и могут влиять на скорость реакции.
- Подслои катализаторов: Катализаторы – вещества, ускоряющие химические реакции – могут образовывать подслой на своей поверхности. Этот подслой служит площадкой для реакции и позволяет участвующим молекулам легче соприкасаться и реагировать, что приводит к более эффективной реакции.
- Подслои в реакциях на границе раздела фаз: В реакциях, происходящих на границе раздела двух фаз (например, газ-жидкость или жидкость-твердое тело), образуются подслои, которые способствуют взаимодействию между фазами и ускоряют реакцию.
Образование подслоев является важным аспектом химических реакций и может оказывать значительное влияние на их протекание и результаты. Изучение и понимание подслоев позволяет более глубоко понять химические процессы.
Ссылки
- Дэй Р. и Андервуд А. (1989). Количественная аналитическая химия (пятое изд.). ПИРСОН Прентис Холл.
- Википедия. (2019). Прокаливание. Получено с: en.wikipedia.org
- Эльзевир. (2019). Прокаливание. ScienceDirect. Получено с: sciencedirect.com
- Hubbe Martin. (н.д.). Мини-энциклопедия химии мокрой части бумажного производства. Получено с: projects.ncsu.edu
- Индраяна, И. П. Т., Сирегар, Н., Сухарьяди, Э., Като, Т. и Ивата, С. (2016). Температурная зависимость микроструктуры, колебательных спектров и магнитных свойств нанокристаллического Mn от температуры прокаливания0.5Zn0.5Вера2ИЛИ4. Journal of Physics: Conference Series, Volume 776, Issue 1, article id. 012021.
- FEECO International, Inc. (2019). Прокаливание. Получено с: feeco.com
- Габер, М. А. Абдель-Рахим, А. Ю. Абдель-Латиф, Махмуд. Н. Абдель-Салам. (2014). Влияние температуры прокаливания на структуру и пористость нанокристаллического SnO.2 Синтезирован обычным методом осаждения. Международный журнал электрохимической науки.
Объясняем процесс
Процесс прокаливания на воздухе обычно выполняется в специальных печах или газоудерживающих камерах. Материал помещается внутрь печи и нагревается до определенной температуры, которая может достигать нескольких сотен градусов Цельсия. В это время материал подвергается окислительным процессам, которые приводят к изменению его состава и свойств.
Прокаливание на воздухе может использоваться для обработки различных материалов, включая металлы, стекло, керамику и полимеры. Оно широко применяется в различных отраслях промышленности, включая металлургию, стекольную и керамическую промышленность, а также в производстве электроники и автомобилей.
Важно отметить, что процесс прокаливания на воздухе может быть опасен из-за выделения токсичных газов и высокой температуры. Поэтому при его проведении необходимо соблюдать все меры безопасности и использовать специальное оборудование, а также проводить обработку в хорошо вентилируемых помещениях
| Преимущества процесса прокаливания на воздухе: | Недостатки процесса прокаливания на воздухе: |
|---|---|
| Удаление примесей и органических веществ | Опасность выделения токсичных газов |
| Изменение свойств материала | Высокая температура |
| Улучшение коррозионной стойкости |
Основные характеристики подслоя
Одной из основных характеристик подслоя является его толщина. Толщина подслоя может быть различной в зависимости от конкретной задачи и материала, с которым он используется. Более тонкий подслои обычно используются для достижения точных результатов, в то время как более толстый подслои могут обеспечивать более высокую прочность или защиту.
Другой важной характеристикой подслоя является его состав. Подслой может быть составлен из различных материалов, таких как пластик, металл или керамика, в зависимости от конкретной задачи и требований. Состав подслоя может определять его свойства, такие как теплопроводность, электропроводность или химическая стойкость
Состав подслоя может определять его свойства, такие как теплопроводность, электропроводность или химическая стойкость.
Также стоит упомянуть о поверхностной отделке подслоя. Поверхностная отделка может варьироваться от грубой до гладкой и может иметь различные эффекты на визуальное и тактильное восприятие материала. Правильная поверхностная отделка может также способствовать адгезии между подслоем и основным материалом.
Важным аспектом подслоя является его применение. Подслой может быть использован для различных целей, включая защиту от коррозии, повышение механической прочности или изменение оптических свойств материала. Применение подслоя контролируется требованиями конкретного проекта или продукта.
В заключение, основные характеристики подслоя включают толщину, состав, поверхностную отделку и применение. Использование подслоя в химии позволяет достичь определенных результатов и улучшить свойства материалов.
Качественные реакции на неорганические вещества и ионы
В неорганической химии класс соединения, наличие тех или иных молекул или ионов также можно определить с помощью качественных реакций. При взаимодействии с определенным реагентом катионы или анионы неорганических соединений провоцируют внешние эффекты — выпадение осадка, окрашивание раствора, выделение газа и т. д.
Например, анион хлора с катионом серебра дает белый творожистый осадок, а если с тем же катионом серебра соединить анион брома — появится светло-желтый осадок. Катион железа в щелочной среде дает бурый осадок. Словом, в неорганике качественные реакции служат таким же полезным инструментом для идентификация химических веществ, как и в органике.
Основные этапы процесса прокаливания на воздухе
Основные этапы процесса прокаливания на воздухе включают:
- Подготовка материала: перед началом процесса материал должен быть очищен от посторонних веществ и загрязнений. Это позволяет избежать нежелательных реакций и получить ожидаемый результат.
- Нагревание материала: очищенный материал помещается в специальную печь, где происходит его нагревание до определенной температуры. Это может занять определенное время в зависимости от материала и его размеров.
- Выдержка при заданной температуре: после достижения нужной температуры, материал оставляют в печи на определенное время. Этот этап необходим для равномерного прокаливания и стабилизации свойств материала.
- Охлаждение на воздухе: после выдержки, материал извлекают из печи и охлаждают на воздухе. Это важный шаг, который позволяет зафиксировать изменения свойств материала после нагревания.
- Оценка качества: окончательный этап процесса – оценка качества прокаленного материала. Используется различное оборудование и методы контроля, чтобы убедиться в достижении необходимых характеристик.
Все эти этапы позволяют достичь желаемых результатов и повысить свойства материалов, таких как прочность, твердость, устойчивость к коррозии и другие.
Прокаливание на воздухе – это сложный и трудоемкий процесс, важный в множестве областей промышленности. Благодаря этому процессу удается получить материалы, отличающиеся высокими эксплуатационными свойствами и многократно увеличенным сроком службы.
Отстаивание
Отстаивание — это разделение неоднородной жидкой смеси на компоненты, путём её расслоения с течением времени под действием силы тяжести.
Отстаиванием можно разделить смесь нерастворимых в воде веществ, имеющих разную плотность.
Пример. Смесь из железных и древесных опилок можно разделить, если высыпать её в сосуд с водой (1), взболтать и дать отстояться. Железные опилки опустятся на дно сосуда, а древесные будут плавать на поверхности воды (2), и их вместе с водой можно будет слить в другой сосуд (3):
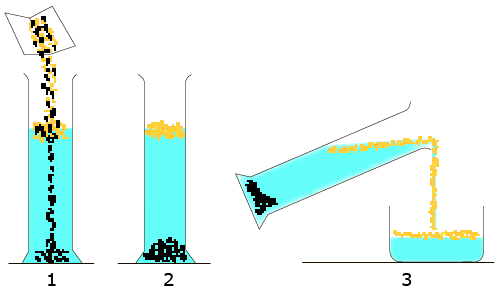
На этом же принципе основано разделение смесей малорастворимых друг в друге жидкостей.
Пример. Смеси бензина с водой, нефти с водой, растительного масла с водой быстро расслаиваются, поэтому их можно разделить с помощью делительной воронки:
Отстаиванием также можно разделить вещества, которые осаждаются в воде с различной скоростью.
Пример. Смесь из глины и песка можно разделить, если высыпать её в сосуд с водой (1), взболтать и дать отстояться. Песок оседает на дно значительно быстрее глины (2):
Этот способ используется для отделения песка от глины в керамическом производстве (производство глиняной посуды, красных кирпичей и др.).
Прокалили вещество: что это значит и как это влияет в химии?
При процессе прокаливания вещество подвергается нагреванию в специальной печи или камере с контролируемой температурой. Обычно применяется высокая температура, но ниже точки плавления вещества.
Прокаливание может привести к различным изменениям в химическом составе и структуре вещества. В результате прокаливания обычно происходит удаление влаги, газов или неорганических примесей из вещества.
Прокаливание может также изменить фазовый состав вещества, повысить его плотность или твердость, а также улучшить его растворимость или химическую стабильность.
Поэтому прокаливание является важным шагом для многих химических процессов и может значительно улучшить свойства и качество вещества.
Что такое равновесие
Чтобы решить 22 задание ЕГЭ по химии, для начала вспомним, что такое равновесие и как его смещать.
Химическое равновесие — состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
Записав уравнение химической реакции в тетради, мы можем понять, какое количество реагентов вступает в эту реакцию, какие продукты мы получаем. Но на практике превращения далеки от идеала. Вещества реагируют не полностью, образуются отходы, возникают потери. Смещение равновесия позволяет регулировать течение реакции так, как этого требует производственный процесс.
Мы будем сталкиваться с понятиями «смещение в сторону прямой реакции» или «в сторону продуктов». Это означает, что в результате реакции мы сможем получить больше продуктов, то есть увеличить выход.
«Смещение в сторону обратной реакции» или «в сторону реагентов» позволяет уменьшить выход продуктов, уменьшить их выход и тем самым увеличить выход обратной реакции.
В 1884 году французский химик Анри Ле Шателье сформулировал принцип, согласно которому, при воздействии на систему, находящуюся в состоянии равновесия (температура, давление, концентрация), система стремится компенсировать внешнее воздействие.
- При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления — в сторону больших газов.
- При увеличении температуры равновесие смещается в сторону эндотермической реакции, при уменьшении — в сторону экзотермической реакции.
- При увеличении концентрации реагентов равновесие смещается в сторону продуктов реакции и наоборот.
Самостоятельно подготовиться к ЕГЭ непросто. На то, чтобы разобраться со всеми темами, понадобится много времени. Но и это не решит проблему! Например, если вы запомнили какое-то решение из интернета, а оно оказалось неправильным, можно на пустом месте потерять баллы
Если хотите научиться решать все задания ЕГЭ по химии, обратите внимание на онлайн-курсы MAXIMUM! Наши специалисты уже проанализировали сотни вариантов ЕГЭ и подготовили для вас максимально полезные занятия.Приходите к нам на консультацию — вы сможете пройти диагностику по выбранным предметам ЕГЭ, поставить цели и составить стратегию подготовки, чтобы получить на экзамене высокие баллы. Все это абсолютно бесплатно!
Способы разделения
В этом типе задания дается смесь веществ, и нужно выбрать оптимальный способ разделения этой смеси.
Делительная воронка используется для разделения двух жидкостей при условии, что одна из них является гидрофильной, а другая гидрофобной. Со временем смесь жидкостей в воронке расслаивается из-за несмешиваемости и становится возможным слить нижнюю фракцию.
Декантация подобна разделению с помощью делительной воронки, только в делительной воронке сливается нижняя фаза, а в декантации верхняя.
Фильтрование используется для отделения из раствора нерастворимого вещества.
С помощью магнита можно разделить смесь двух металлов при условии, что один из них намагничивается.
С помощью фракционной перегонки разделяют смешиваемые жидкости. Например, если нагревать смесь воды и спирта, то спирт испарится раньше воды. Пары спирта можно будет собрать, охладить и поместить в отдельную емкость.
Если есть смесь двух твердых веществ, одно из которых растворимо в воде, а другое нет, то их можно разделить с помощью обработки водой, фильтрования и выпаривания раствора.
Положительные и отрицательные эффекты
Прокаливание вещества — процесс, при котором вещество подвергается нагреванию до определенной температуры. Этот процесс может оказывать как положительное, так и отрицательное влияние на организм человека.
Положительные эффекты:
- Усиление эффекта вещества. Прокаливание вещества может усилить его свойства и воздействие на организм. Например, при прокаливании некоторых травяных компонентов можно достичь более сильного эффекта лечения.
- Улучшение усвояемости вещества. Нагревание вещества может способствовать улучшению его усвояемости организмом. Например, прокаливание зерна может повысить его питательную ценность и облегчить его переваривание.
Отрицательные эффекты:
- Разрушение активных компонентов. Высокие температуры при прокаливании могут разрушить активные компоненты вещества, что может уменьшить его эффективность и полезные свойства.
- Выделение вредных веществ. Прокаливание некоторых веществ может привести к выделению вредных или токсичных веществ, которые могут негативно влиять на организм.
- Изменение вкусовых и ароматических свойств. Прокаливание вещества может изменить его вкусовые и ароматические свойства, что может сделать его менее привлекательным для потребления.
В целом, эффекты прокаливания вещества на организм зависят от конкретного вещества и условий прокаливания
Поэтому важно учитывать эти факторы при использовании прокаленных веществ для лечения или питания
Понятие свойства в химии
Свойство в химии — это характеристика вещества или системы веществ, которая остается неизменной при изменении условий их существования. Свойства в химии можно разделить на следующие типы:
- Физические свойства: описывают физические характеристики вещества, которые можно измерить без изменения его химической структуры. Например, плотность, температура плавления, температура кипения.
- Химические свойства: характеризуют способность вещества взаимодействовать с другими веществами и претерпевать химические изменения. Например, способность окисляться, восстанавливаться, образовывать соединения с другими веществами.
Кроме того, свойства могут быть классифицированы по различным критериям:
- По отношению к агрегатному состоянию: свойства газов, свойства жидкостей, свойства твердых веществ.
- По природе вещества: свойства органических и неорганических веществ.
- По пространственной ориентации: изотропные и анизотропные свойства.
- По степени зависимости от внешнего воздействия: интенсивные и экстенсивные свойства.
Примеры физических и химических свойств вещества
Физические свойства
Химические свойства
Цвет
Окисляемость
Плотность
Способность кислотности
Температура плавления
Способность взаимодействовать с другими веществами
Температура кипения
Образование соединений
Понимание свойств в химии важно для понимания и изучения реакций веществ и получения новых веществ с определенными свойствами. Изучение свойств в химии позволяет определить вещества, проводить исследования и разрабатывать новые материалы и технологии
Слайд 14Фазовые состояния полимеровСвойства полимера зависят не только от химического состава полимера
и формы макромолекулы, но и от их взаимного расположения. Макромолекулы разных полимеров имеют различный химический состав, длину, форму и степень гибкости. На гибкость цепей макромолекул значительное влияние оказывают силы межмолекулярного взаимодействия. Эти силы ограничивают в известной степени свободу перемещения отдельных звеньев цепи. Характер вращения цепи определяется кинетической энергией макромолекулы, и для изменения как характера вращения, так и формы цепи требуется сообщить ей определенное количество энергии (например, тепловой), которое называется энергетическим барьером макромолекулы. В зависимости от пространственного расположения макромолекулы друг относительно друга изменяются степень их гибкости и эластичность полимера, что, в свою очередь, определяет характер деформации материала при механическом воздействии.

Способы разделения однородных смесей
Для выделения из готового состава растворенных компонентов принято использовать химические процессы. Разберем основные химические способы.
Выпаривание
В основу выпаривания заложены физические свойства компонентов смеси, а именно способность кипеть при разных температурах.
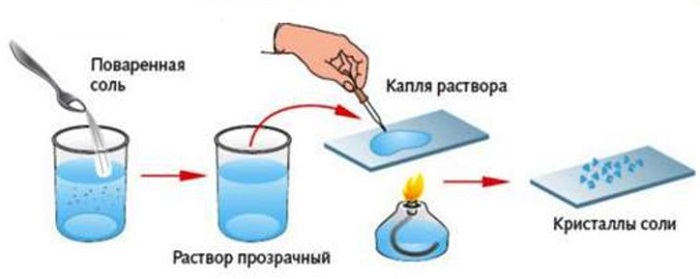
В ходе такого процесса состав можно разделить на жидкие и растворимые вещества. Например, вода и соль, или вода и сахар.
Выпариванием пользуются при необходимости выделения из имеющейся смеси только твердого ингредиента.
С температурами кипения отдельных веществ можно предварительно ознакомиться в справочниках по химии или физике. Данные представлены в наглядных таблицах.
Кристаллизация
Кристаллизацией называют процесс формирования кристаллов из стекол, газов, расплавов и растворов. Такую же формулировку применяют при образовании кристаллов с полученной структурой из кристаллов другого структурного класса, так называемые полиморфные превращения, либо при смене состояния вещества из жидкого на твердое кристаллическое.

Методом кристаллизации пользуются для выделения больших образований твердого вещества. Жидкость испаряется частично.
Раствор нагревают до определенной температуры и оставляют открытым на долгий период времени. При медленном испарении жидкости растворенное вещество выпадает в осадок в виде кристаллов. Таким методом в промышленных масштабах добывают соль из природной соленой воды.
Дистилляция (перегонка)
Метод перегонки основан на испарении летучих жидкостей, которые в дальнейшем превращаются в конденсат.

При нагревании раствора летучий компонент превращается в пар и оседает на стенках сосудов в виде капель конденсата.
Дистилляцию применяют в процессе опреснения морской воды, что очень актуально для стран с острой нехваткой питьевой воды.
Дистилляция – это основной метод переработки нефти, которая, по сути, является многокомпонентной смесью. В результате перегонки получают различные виды топлива.
Хроматография
Хроматография основана на способности поверхности определенных веществ с разной интенсивностью поглощать разделяемые компоненты.

Процесс можно рассмотреть на простом практическом примере – разделении красителей фильтровальной бумагой. При погружении конца полоски бумаги в раствор, растворители будут подниматься на разную высоту и с различной скоростью.
В промышленных масштабах фильтровальную бумагу заменяют углем, мелом, известняком и прочими веществами. Для разделения многокомпонентных растворов используют хроматографы. Они не только разделяют смеси, но и устанавливают их состав.
Классификация и номенклатура органических соединений[править | править код]
Классификация объектов, веществ и их схемы в химииправить | править код
Для чего науке нужны классификации объектов? Какие классификации веществ вам известны? Приведите их схемы и примеры веществ. По каким классификацианным признакам проведено разделение веществ на классы?
Классификация является важнейшим методом систематизации. Смысл классификации прост. Все многообразие объектов, требующих осмысления или какой-либо обработки, организуется в виде упорядоченной системы. Классификация позволяет выделить из всего многообразия объектов группы с интересующими исследователя свойствами и сосредоточиться на их изучении. Классификация объектов проводится с целью установления наследственных связей между объектами. Свойство наследования позволяет изучать характеристики всех объектов класса, не привязываясь к конкретному экземпляру. Классификация позволяет систематизировать знания об объектах любой природы и назначения.
Самая простая классификация заключается в том, что все известные вещества делят на неорганические и органические.
Неорганические вещества по составу делят на простые и сложные. Сложные неорганические вещества по составу и свойствам распределяют по следующим важнейшим классам: оксиды, основания, кислоты, амфотерные гидроксиды,
соли. Оксиды, в свою очередь, классифицируют на солеобразующие и несолеобразующие. Солеобразующие делятся на основные, амфотерные, кислотные, которым соответствуют основания, амфотерные гидроксиды и кислоты соответственно. Основания делятся на растворимые (щелочи) и нерастворимые и т.д.
В зависимости от строения углеродной цепи органические соединения разделяют на соединения с открытой цепью ациклические и циклические — с замкнутой цепью атомов. Циклические делятся на две группы: карбоциклические соединения и гетероциклические. Карбоциклические соединения, в свою очередь, включают два ряда соединений: алициклические и ароматические. Как ациклические, так и циклические углеводороды могут содержать кратные (двойные или тройные) связи. Такие углеводороды называют непредельными (ненасыщенными), в отличие от предельных (насыщенных), содержащих только одинарные связи. Все сказанное о классификации органических веществ в зависимости от
строения углеродной цепи с примерами изображено на схеме (Схема 1 и схема 2).
Развернутые и сокращенные структурные формулы некоторых веществправить | править код
Напишите развернутые и сокращенные структурные формулы перечисленных веществ. На какую группу атомов отличается состав каждого из последующих веществ? Какую общую формулу можно установить для всех этих веществ?
| Химическое вещество | Сокращённая формула | Развёрнутая формула |
|---|---|---|
| Метан | CH4{\displaystyle {\ce {CH4}}} | H−C|HH|−H{\displaystyle {\ce {H-{\overset {\displaystyle H \atop |}{\underset {| \atop \displaystyle H}{C}}}-H}}} |
| Этан | CH3−CH3{\displaystyle {\ce {CH3-CH3}}} | H−C|HH|−C|HH|−H{\displaystyle {\ce {H-{\overset {\displaystyle H \atop |}{\underset {| \atop \displaystyle H}{C}}}-{\overset {\displaystyle H \atop |}{\underset {| \atop \displaystyle H}{C}}}-H}}} |
| Пропан | CH3−CH2−CH3{\displaystyle {\ce {CH3-CH2-CH3}}} | H−C|HH|−C|HH|−C|HH|−H{\displaystyle {\ce {H-{\overset {\displaystyle H \atop |}{\underset {| \atop \displaystyle H}{C}}}-{\overset {\displaystyle H \atop |}{\underset {| \atop \displaystyle H}{C}}}-{\overset {\displaystyle H \atop |}{\underset {| \atop \displaystyle H}{C}}}-H}}} |
| Бутан | CH3−CH2−CH2−CH3{\displaystyle {\ce {CH3-CH2-CH2-CH3}}} | H−C|HH|−C|HH|−C|HH|−C|HH|−H{\displaystyle {\ce {H-{\overset {\displaystyle H \atop |}{\underset {| \atop \displaystyle H}{C}}}-{\overset {\displaystyle H \atop |}{\underset {| \atop \displaystyle H}{C}}}-{\overset {\displaystyle H \atop |}{\underset {| \atop \displaystyle H}{C}}}-{\overset {\displaystyle H \atop |}{\underset {| \atop \displaystyle H}{C}}}-H}}} |
Состав каждого из последующих веществ отличается на CH2{\displaystyle {\ce {CH2}}}-группу. Общая формула CnH2n+2{\displaystyle {\ce {{C_{n}}H_{{2n}+2}}}}



























