Каким способом эффективнее определять концентрацию рабочих растворов?
Согласно требованиям системы ХАССП на любом пищевом производстве в обязательном порядке должна проводиться санитарная обработка предприятия.
После того, когда все средства подобраны, апробированы и закуплены и ими начинают пользоваться, встает вопрос о контроле концентрации рабочих растворов моющих и дезинфицирующих средств. Для этого существует несколько способов:
— титриметрический метод (титрование кислотно-основное, окислительно-восстановительное, двухфазное и т.д.)
— использование тест-полосок для количественного определения ДВ (активный хлор, НУК, ЧАС, ПВ) в растворе.
— использование тест-полосок индивидуально разработанных для определения концентрации рабочих растворов конкретных препаратов (Катрил-Септ, Катрил-Дез-Вет и др.)
— определение электропроводности рабочих растворов.
Рассмотрим каждый способ более подробно:
Метод титрования:
Для этого способа определения концентрации рабочих раствор необходима лаборатория с лаборантом, так как даже обычное кислотно-основное титрование подразумевает процесс приготовления реактивов, подбора лабораторной посуды и т.д. На крупных и средних предприятиях такие лаборатории имеются, и сотрудникам не составляет труда, по предоставленной производителем методике, провести анализ. На каждое из средств мы предоставляем полную информацию по методам входного контроля и проверке концентраций.
Но что же делать предприятиям, у которых такой возможности нет? У которых нет лаборатории или доступа к лабораторному оборудованию.
Тогда можно использовать тест-полоски:
Использовать тест-полоски для определения количества действующих веществ, таких как активный хлор, ЧАС, надуксусную кислоту и перекись водорода. При данном способе определяется концентрация рабочих растворов по ДВ, далее с помощью предоставленной таблицы перевести определенное количество ДВ в концентрацию по препарату.
Еще один способ определения концентрации рабочих растворов по препарату это использование тест-полосок для конкретного средства. Мы с помощью наших партнеров (компания Винар) разработали тест-полоски на средства Катрил-Дез-Вет и Катрил-Септ, так как химические методы определения достаточно трудоемки и занимают длительное время .
С помощью электропроводности раствора:
И последний метод это проверка концентрации с помощью электропроводности раствора. Единственное ограничение, если средство не содержит в составе электролитов или содержит очень малые их количества (например, нейтральные средства, состоящие из комплекса ПАВ), то данный способ к нему не применим.
Для этих целей необходимо приобрести кондуктометр. Этот прибор настолько прост, что его может использовать любой обученный работник производства. Для каждого средства мы строим график электропроводности, по которому можно сразу определить концентрацию рабочего раствора по препарату. Весь процесс занимает не более 5 минут.
В нашей лаборатории и НТЦ мы используем кондуктометр от компании ЭКОНИКС.
А каким способом определяете вы концентрацию рабочих растворов?
Все дополнительные вопросы вы можете задать мне, технологу по работе с клиентами БН ХПП — Тереховой Светлане
Источник
Природа растворенного вещества и растворителя
Подобно тому, как растворять подобное — это хорошо известное утверждение, которое контролирует процесс растворимости, это утверждение можно объяснить следующим образом:
Полярный растворитель, такой как вода, растворяет ионные соединения (хлорид натрия NaCl, гидроксид натрия NaOH, нитрат никеля Ni (NO 3 ) 2 ), а вода растворяет полярные соединения (хлористый водород HCl, аммиак NH 3 ).
Неполярный растворитель (органический растворитель), такой как бензол, растворяет неполярные соединения (метан, масло, жиры), а дихлорид метана растворяет неполярный материал (йод).
Растворимость некоторых веществ в полярных и неполярных растворителях
Три пробирки содержат гетерогенную смесь воды и дихлорида метана .
В первой трубке , дихлорид метана не растворяется в воде , потому что вода является полярным растворителем, в то время как дихлорид метана является неполярным веществом , в котором неполярные вещества не растворяются в полярных растворителях .
Во второй трубе , путем добавления раствора йода к этой гетерогенной смеси , растворяется в дихлорид метана, но не растворяется в воде , так как раствор йода является неполярным веществом и метан дихлорид также является неполярным растворителем, но вода является полярным растворителем , в котором неполярные вещества не растворяются в полярных растворителях, но растворяются в неполярных растворителях.
В третьей пробирке при добавлении зеленого нитрата никеля к этой гетерогенной смеси он растворяется в воде и не растворяется в дихлориде метана, потому что нитрат никеля является полярным веществом, а вода — полярным растворителем, а дихлорид метана неполярным. растворитель , в котором ионные вещества растворяются в полярных растворителях , но не растворяются в неполярных растворителях.
Масло не растворяется в воде, потому что вода является полярным растворителем, а масло — неполярным соединением. Таким образом, масло не растворяется в воде .
Масло растворимо в бензоле, потому что масло (неполярное вещество) диспергировано между молекулами бензола (неполярный растворитель) из-за слабых связей между молекулами бензола.
Сахар растворим в воде , хотя сахар является неполярным веществом, потому что молекулы воды образуют водородные связи с молекулами сахара (полярные гидроксильные группы).
Что такое молярность?
Количество молей данного растворенного вещества, растворенного в данном литре раствора, известно как молярность. Молярность представлена символом «М». Формула для математического расчета молярности приведена ниже:
M = количество молей данного растворенного вещества/объем в
литров
Стандартной единицей молярности является моль/л, или моль или М. Рассмотрим пример, приведенный ниже: 0.25 моль/л раствора гидроксида натрия означает, что в 0.25 литре (или 1 кубическом дециметре) раствора растворено 1 моль гидроксида натрия.
Так как объем данного раствора увеличивается с повышением температуры раствора, то вместе с ним уменьшается и молярность раствора, а объем раствора уменьшается с понижением температуры.
Таким образом, молярность раствора увеличивается с понижением температуры.
Для сложных задач данное уравнение М1В2 = M2V2 используется для определения молярности раствора. Например – Растворите 4 г гидроксида натрия в 250 мл воды. Какова молярность полученного раствора?
Производство – Масса гидроксида натрия = 4.0 г
Молярная масса гидроксида натрия, NaOH = 23 (Na) + 16 (O) + 1 (H) = 40.0 г/моль.
Объем воды в литрах = 250/1000 = 0.25 л.
Количество молей = Масса гидроксида натрия / Молярная масса гидроксида натрия
= 4/40 = 0.1 моль
Молярность = количество молей гидроксида натрия/объем раствора в литре.
= 0.1/0.25 = 0.4 М
моляльность
Молальность обозначается строчной буквой м и равно молям растворенного вещества, которые присутствуют в одном (1) килограмме растворителя. Он также называется молярной концентрацией и рассчитывается по следующей формуле:
m = молей растворенного вещества / кг растворителя
В то время как молярность устанавливает отношение молей растворенного вещества, содержащихся в одном (1) литре раствора, моляльность относится к молям растворенного вещества, которые существуют в одном (1) килограмме растворителя.
В тех случаях, когда раствор готовится с использованием более чем одного растворителя, молярность будет выражать то же, что и число молей растворенного вещества на килограмм смеси растворителей..
Упражнение 1
Определите моляльность раствора, который был приготовлен путем смешивания 150 г сахарозы (с12H22011) с 300 г воды.
Молекулярная масса сахарозы определяется в первую очередь, чтобы перейти к расчету молей растворенного вещества этого раствора:
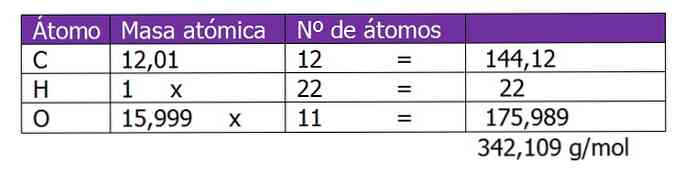
Количество молей сахарозы рассчитывается:
n = (150 г сахарозы) / (342,109 г / моль)
n = 0,438 молей сахарозы
После того, как граммы растворителя взяты в килограммах, чтобы применить окончательную формулу.
Подставляя тогда:
m = 0,438 моль сахарозы / 0,3 кг воды
m = 1,46 моль C12H22011/ Кг В2О
Хотя в настоящее время ведутся дебаты об окончательном выражении молальности, этот результат также может быть выражен как:
1,26 м12H22011 или 1,26 моль
В некоторых случаях считается выгодным выражать концентрацию раствора в терминах моляльности, поскольку массы растворенного вещества и растворителя не подвержены незначительным колебаниям или невидимым изменениям из-за воздействия температуры или давления; как это происходит в растворах с газообразным веществом.
Кроме того, указывается, что эта единица концентрации, относящаяся к конкретному растворенному веществу, не изменяется при наличии других растворенных веществ при растворении..
моли в миллимоли
Как рассчитать моляльность?
Используйте формулу моли = масса растворенного вещества / молярная масса . Предположим, мы хотим растворить 70,128 г соли в 1,5 кг воды. поэтому моли NaCl = 70,128 г/(58,44 г/моль) = 1,2 моль. Подставьте число молей и массу растворителя в формулу моляльности.
Как рассчитать молярную концентрацию?
Для расчета молярной концентрации найдем молярная концентрация путем деления молей на литры воды, использованные в растворе. Например, уксусная кислота здесь полностью растворена в 1,25 л воды. Затем разделите 0,1665 моль на 1,25 л, чтобы получить молярную концентрацию, которая будет равна 0,1332 М.
Какая формула перевода молей в граммы?
Моли в граммы пример задачи
Решение: Узнайте молярную массу вещества (подсказка: для расчета молярной массы можно использовать только Молярную массу вещества). Молярная масса KClO3 составляет 122,548 г/моль. Умножить заданное количество молей (2,50 моль) на молярную массу (122,548 г/моль), чтобы получить граммы.
Как считать эквиваленты?
Чтобы рассчитать молярные эквиваленты для каждого реагента, разделите моли этого реагента на моли лимитирующего реагента: Обратите внимание, что молярный эквивалент бензоата натрия равен 1. Это связано с тем, что бензоат натрия является ограничивающим реагентом. Любые реагенты, используемые в избытке, будут иметь молярную эквивалентность больше единицы
Любые реагенты, используемые в избытке, будут иметь молярную эквивалентность больше единицы.
Что такое микромолярная концентрация?
Слушайте произношение. (MY-kroh-MOH-ler) Концентрация 1/1 000 000 (одна миллионная) молекулярной массы на литр (Молл).
Как рассчитать рН?
Расчет pH
pH определяется следующим уравнением: pH = -log , где обозначает молярную концентрацию ионов водорода
Обратите внимание, что мы должны взять десятичный логарифм концентрации ионов водорода, чтобы рассчитать рН
Как рассчитать M1V1 M2V2?
Вы можете найти концентрацию или объем концентрированного или разбавленного раствора, используя уравнение: М1В1 = М2В2, где М1 — молярная концентрация (моль/литры) концентрированного раствора, V2 — объем концентрированного раствора, М2 — молярная концентрация разбавленного раствора (после …
Является ли M таким же, как моль дм 3?
Единицами измерения молярной концентрации в системе СИ являются моль/м3. Однако в большей части химической литературы традиционно используется моль/дм3, или моль дм-3, т.е. то же, что моль/л. … моль/м3 = 10-3 моль/дм3 = 10-3 моль/л = 10-3 М = 1 мМ .
Что такое 1 молярный раствор?
1 молярный (М) раствор будет содержать 1,0 GMW вещества, растворенного в воде, для получения 1 л конечного раствора. Следовательно, 1М раствор NaCl содержит 58,44 г. Пример: HCl часто используется в гистохимии ферментов.
Как рассчитать концентрацию раствора?
Разделите массу растворенного вещества на общий объем раствора. Напишите уравнение С = м/В, где m — масса растворенного вещества, а V — общий объем раствора. Подставьте найденные значения массы и объема и разделите их, чтобы найти концентрацию раствора.
Каковы единицы концентрации?
Молярность (М) указывает количество молей растворенного вещества на литр раствора (моль/литр) и является одной из наиболее распространенных единиц, используемых для измерения концентрации раствора. Молярность можно использовать для расчета объема растворителя или количества растворенного вещества.
Какова формула массовой концентрации?
Для чистого химического вещества массовая концентрация равна его плотности (масса, деленная на объем); таким образом, массовую концентрацию компонента в смеси можно назвать плотностью компонента в смеси. Это объясняет использование ρ (строчная греческая буква ро), символа, наиболее часто используемого для обозначения плотности.
Пример моляльности?
Моляльность определяется как количество молей растворенного вещества в 1000 г растворителя. В отличие от молярности, моляльность не меняется с температурой, поскольку изменение температуры влияет на массу. … Пример: Рассчитайте моляльность раствора, приготовленного из 29,22 г NaCl в 2,00 кг воды.
Как рассчитать моляльность воды?
Моляльность ( m ) раствора равна моль растворенного вещества разделить на килограммы растворителя. Раствор, содержащий 1,0 моль NaCl, растворенный в 1,0 кг воды, является «одномоляльным» раствором хлорида натрия.
Какова формула повышения температуры кипения?
Температура кипения воды составляет 100 градусов по Цельсию. Уравнение для повышения температуры кипения: дельта Т = мКб.
Преимущества использования миллимолярных растворов
1. Точность и удобство измерений. Использование миллимолярных растворов позволяет проводить измерения с высокой точностью. Удобное выражение концентрации в миллимолярных единицах упрощает расчеты и анализ результатов.
2. Стандартизация экспериментов. Миллимолярные растворы являются стандартными и унифицированными, что позволяет проводить сравнительные эксперименты и получать воспроизводимые результаты.
3. Удобство приготовления растворов. Миллимолярные растворы легко приготовить, так как требуется простое соотношение между количеством вещества и объемом растворителя.
4. Облегчение стандартизации лекарственных препаратов. Миллимолярные растворы используются в фармацевтической промышленности для стандартизации дозировки лекарственных препаратов, что позволяет обеспечивать более точное и надежное лечение пациентов.
5. Повышение эффективности аналитических методов. Миллимолярные растворы позволяют проводить аналитические методы с высокой чувствительностью и точностью, что помогает идентифицировать и количественно определить вещества в различных образцах.
В целом, использование миллимолярных растворов имеет большие преимущества, связанные с точностью и удобством измерений, стандартизацией экспериментов, удобством приготовления растворов, стандартизацией лекарственных препаратов и повышением эффективности аналитических методов.
Вычисление концентрации
Чтобы получить раствор, необходимо между собой смешать растворитель и растворимое. Для того чтобы вычислить концентрацию, нужно знать или найти общий объём смеси, который будет равен сумме элементов, используемых при создании раствора. Измеряться концентрация может в различных величинах. Основные из них:
- грамм на литр (г/л) — отношение массы к объёму;
- молярность (моль) — содержание растворенных элементов к объёму раствора;
- миллионная часть (г / единица раствора) — соотношение растворённых веществ к одному миллиону единиц смеси;
- проценты (%) — ответ выражается в количестве растворённой доли в граммах к ста частям раствора.
Каждый элемент характеризуется молярной массой и определяется отношением массы к числу моль. Равна она атомной массе, которую можно взять из таблицы Менделеева. Для нахождения молярной величины нужно сложить все атомные числа элементов, смешанных в растворе.
Найдя молекулярное значение можно перейти к вычислению количества молей. Делается это с помощью формулы для молярной концентрации: масса растворённого вещества умножается на обратную молярную часть. Результат должен получиться в моль. На следующем этапе находится молярность. Полученное число молей делится на объём, измеряемого в литрах раствора. Обычно объёмом растворённой части пренебрегают.
По аналогии вычисляется концентрация и в процентном составе. Для этого нужно найти массу частей, составляющих раствор. На первом этапе все единицы измерения переводятся в граммы. Находится плотность, затем она умножается на объём и получается масса вещества в граммах. Вычисление концентрации в процентном составе находится как масса растворённого вещества, делённая на сумму массы растворяемого и растворителя, а после результат умножается на сто.
Origin[edit]
The term molality is formed in analogy to molarity which is the molar concentration of a solution. The earliest known use of the intensive property molality and of its adjectival unit, the now-deprecated molal, appears to have been published by G. N. Lewis and M. Randall in the 1923 publication of Thermodynamics and the Free Energies of Chemical Substances. Though the two terms are subject to being confused with one another, the molality and molarity of a dilute aqueous solution are nearly the same, as one kilogram of water (solvent) occupies the volume of 1 liter at room temperature and a small amount of solute has little effect on the volume.
Общие сведения
Один моль углерода — это количество вещества, в котором содержится такое же число атомов как в 12 граммах углерода-12, то есть 6×10²³ атомов.
Концентрацию раствора можно измерять разными способами, например как отношение массы растворенного вещества к общему объему раствора. В этой статье мы рассмотрим молярную концентрацию, которую измеряют как отношение между количеством вещества в молях к общему объему раствора. В нашем случае вещество — это растворимое вещество, а объем мы измеряем для всего раствора, даже если в нем растворены другие вещества. Количество вещества — это число элементарных составляющих, например атомов или молекул вещества. Так как даже в малом количестве вещества обычно большое число элементарных составляющих, то для измерения количества вещества используют специальные единицы, моли. Один моль равен числу атомов в 12 г углерода-12, то есть это приблизительно 6×10²³ атомов.
Использовать моли удобно в случае, если мы работаем с количеством вещества настолько малым, что его количество легко можно измерить домашними или промышленными приборами. Иначе пришлось бы работать с очень большими числами, что неудобно, или с очень маленьким весом или объемом, которые трудно найти без специализированного лабораторного оборудования. Чаще всего при работе с молями используют атомы, хотя возможно использовать и другие частицы, например молекулы или электроны. Следует помнить, что если используются не атомы, то необходимо это указать. Иногда молярную концентрацию также называют молярностью.
Следует не путать молярность с моляльностью. В отличии от молярности, моляльность — это отношение количества растворимого вещества к массе растворителя, а не к массе всего раствора. Когда растворитель — вода, а количество растворимого вещества по сравнению с количеством воды мало, то молярность и моляльность похожи по значению, но в остальных случаях они обычно отличаются.
 Вес одного моля разных веществ. Его можно найти с помощью таблицы Менделеева.
Вес одного моля разных веществ. Его можно найти с помощью таблицы Менделеева.
Молярная концентрация
М¾Ã»ÃÂÃÂýðàúþýÃÂõýÃÂÃÂðÃÂøàâ úþûøÃÂõÃÂÃÂòþ òõÃÂõÃÂÃÂòð (ò üþûÃÂÃÂ) ò þñÃÂõüõ ÃÂðÃÂÃÂòþÃÂð.
ÃÂþûøÃÂõÃÂÃÂòþ ÃÂðÃÂÃÂòþÃÂõýýþóþ òõÃÂõÃÂÃÂòð (ò üþûÃÂÃÂ) òÃÂÃÂðöðõÃÂÃÂàúðú üðÃÂÃÂð òõÃÂõÃÂÃÂòð (ò óÃÂðüüðÃÂ), ôõûõýýðàýð üþûÃÂÃÂýÃÂàüðÃÂÃÂà(ó/üþûÃÂ).
÷=mxMeta =frac{m_{x}}{M}
ÃÂþûÃÂÃÂýðàúþýÃÂõýÃÂÃÂðÃÂøàòÃÂÃÂðöðõÃÂÃÂàò ÃÂþÃÂüÃÂûõ:
Cx=÷V=÷=mxMÃÂVC_{x} = frac{eta }{V} = eta =frac{m_{x}}{M}times V
Единицы концентрации
Как описано в предыдущих разделах, при количественном расчете концентрации раствора расчеты должны основываться на существующих единицах для этой цели..
Кроме того, единицы концентрации делятся на единицы относительной концентрации, концентрации разбавленных, основанные на молях и другие дополнительные единицы..
Единицы относительной концентрации
Относительные концентрации выражены в процентах, как было указано в предыдущем разделе. Эти единицы делятся на массовый процентный процент, объемный процентный процент и массовый объемный процент и рассчитываются следующим образом:
— % массы = масса растворенного вещества (г) / масса всего раствора (г) х 100
— % объем = объем растворенного вещества (мл) / объем общего раствора (мл) х 100
— % масса / объем = масса растворенного вещества (г) / общий объем раствора (мл) х 100
В этом случае для расчета массы или объема общего раствора необходимо прибавить массу или объем растворенного вещества к массе растворителя..
Единицы разбавленной концентрации
Единицы разбавленной концентрации — это те, которые используются для выражения тех очень малых концентраций, которые находятся в виде следов в разбавленном растворе; Наиболее распространенное использование, которое представляется этим устройствам, — это обнаружение следов растворенного газа в другом веществе, которое загрязняет воздух..
Эти единицы указаны в виде частей на миллион (частей на миллион), частей на миллиард (частей на миллион) и частей на триллион (частей на миллион) и выражаются следующим образом:
— м.д. = 1 мг растворенного вещества / 1 л раствора
— ppb = 1 мкг растворенного вещества / 1 л раствора
— ppt = 1 нг растворенного вещества / 1 л раствора
В этих выражениях мг равен миллиграммам (0,001 г), мкг равен микрограммам (0,000001 г) и нг равен нанограммам (0,000000001 г). Эти единицы также могут быть выражены через объем / объем.
Единицы концентрации по молям
Единицами концентрации, основанными на молях, являются молярная доля, молярный процент, молярность и молярность (последние два лучше описаны в конце статьи).
Молярная доля вещества — это доля всех составляющих его молекул (или атомов) как функция от общих молекул или атомов. Он рассчитывается следующим образом:
X = количество молей вещества A / общее количество молей в растворе
Эта процедура повторяется для других веществ в растворе, принимая во внимание, что сумма Х + XВ + XС … должен быть равен единице
Молярный процент работает аналогично Х, только это в зависимости от процента:
Молярный процент А = Х х 100%
В заключительном разделе молярность и моляльность будут обсуждаться подробно.
Формальность и нормальность
Наконец, есть две единицы концентрации, которые в настоящее время не используются: формальность и нормальность.
Формальность решения представляет собой вес-формулу-грамм на литр всего раствора. Это выражается как:
F = № P.F.G / L раствор
В этом выражении P.F.G равен весу каждого атома вещества, выраженному в граммах.
Вместо этого нормальность представляет собой количество растворенных эквивалентов, деленное на литры раствора, как указано ниже:
N = эквивалентные граммы растворенного вещества / л раствора
В указанном выражении эквивалентные граммы растворенного вещества можно рассчитать по количеству молей H+, Огайо- или другие методы, в зависимости от типа молекулы.
Общие свойства растворов
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации.. В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры
Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов.
Понятие о растворах. Растворимость веществ

Растворы — гомогенные (однородные) системы переменного состава, которые содержат два или несколько компонентов.
Наиболее распространены жидкие растворы. Они состоят из растворителя (жидкости) и растворенных веществ (газообразных, жидких, твердых):
Жидкие растворы могут быть водные и неводные. Водные растворы — это растворы, в которых растворителем является вода. Неводные растворы — это растворы, в которых растворителями являются другие жидкости (бензол, спирт, эфир и т. д.). На практике чаще применяются водные растворы.
Растворение веществ
Растворение — сложный физико-химический процесс. Разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя — это физический процесс. Одновременно происходит взаимодействие молекул растворителя с частицами растворенного вещества, т.е. химический процесс. В результате этого взаимодействия образуются сольваты.
Сольваты — продукты переменного состава, которые образуются при химическом взаимодействии частиц растворенного вещества с молекулами растворителя.
Если растворителем является вода, то образующиеся сольваты называются гидратами. Процесс образования сольватов называется сольватацией. Процесс образования гидратов называется гидратацией. Гидраты некоторых веществ можно выделить в кристаллическом виде при выпаривании растворов. Например:
Что представляет собой и как образуется кристаллическое вещество синего цвета? При растворении в воде сульфата меди (II) происходит его диссоциация на ионы:
Образующиеся ионы взаимодействуют с молекулами воды:
При выпаривании раствора образуется кристаллогидрат сульфата меди (II) — CuSО4 • 5Н2О.
Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами. Вода, входящая в их состав, называется кристаллизационной водой. Примеры кристаллогидратов:
Впервые идею о химическом характере процесса растворения высказал Д. И. Менделеев в разработанной им химической (гидратной) теории растворов (1887 г.). Доказательством физико-химического характера процесса растворения являются тепловые эффекты при растворении, т. е. выделение или поглощение теплоты.
Тепловой эффект растворения равен сумме тепловых эффектов физического и химического процессов. Физический процесс протекает с поглощением теплоты, химический — с выделением.
Если для разрушения структуры вещества необходимо больше теплоты, чем ее образуется при гидратации, то растворение — эндотермический процесс. Это происходит, например, при растворении в воде NaNО3, KCl, K2SO4, KNO2, NH4Cl и др.
Растворимость веществ
Мы знаем, что одни вещества хорошо растворяются, другие — плохо. При растворении веществ образуются насыщенные и ненасыщенные растворы.
Насыщенный раствор — это раствор, который содержит максимальное количество растворяемого вещества при данной температуре.
Ненасыщенный раствор — это раствор, который содержит меньше растворяемого вещества, чем насыщенный при данной температуре.
Количественной характеристикой растворимости является коэффициент растворимости. Коэффициент растворимости показывает, какая максимальная масса вещества может раствориться в 1000 мл растворителя при данной температуре.
Растворимость выражают в граммах на литр (г/л).
По растворимости в воде вещества делят на 3 группы:
Таблица растворимости солей, кислот и оснований в воде:
Растворимость веществ зависит от природы растворителя, от природы растворенного вещества, температуры, давления (для газов). Растворимость газов при повышении температуры уменьшается, при повышении давления — увеличивается.
Зависимость растворимости твердых веществ от температуры показывают кривые растворимости. Растворимость многих твердых веществ увеличивается при повышении температуры.
По кривым растворимости можно определить: 1) коэффициент растворимости веществ при различных температурах; 2) массу растворенного вещества, которое выпадает в осадок при охлаждении раствора от t1oC до t2oC.
Процесс выделения вещества путем испарения или охлаждения его насыщенного раствора называется перекристаллизацией. Перекристаллизация используется для очистки веществ.
Molalities of a ternary or multicomponent solution[edit]
The molalities of solutes b1, b2 in a ternary solution obtained by mixing two binary aqueous solutions with different solutes (say a sugar and a salt or two different salts) are different than the initial molalities of the solutes bii in their binary solutions.
The content of solvent in mass fractions w01 and w02 from each solution of masses ms1 and ms2 to be mixed as a function of initial molalities is calculated. Then the amount (mol) of solute from each binary solution is divided by the sum of masses of water after mixing:
Mass fractions of each solute in the initial solutions w11 and w22
are expressed as a function of the initial molalities b11, b22 :
These expressions of mass fractions are substituted in the final molalitaties.
The results for a ternary solution can be extended to a multicomponent solution (with more than two solutes).
From the molalities of the binary solutionsedit
The molalities of the solutes in a ternary solution can be expressed also from molalities in the binary solutions and their masses:
The binary solution molalities are:
The masses of the solutes determined from the molalities of the solutes and the masses of water can be substituted in the expressions of the masses of solutions:
Similarly for the mass of the second solution:
From here one can obtain the masses of water to be summed in the denominator of the molalitities of the solutes in the ternary solutions.
Thus the ternary molalities are:









![Перевести единицы: молярный [м] в миллимолярный [мм или 0.001м] • конвертер молярной концентрации • гидравлика и гидромеханика — жидкости • компактный калькулятор • онлайн-конвертеры единиц измерения](http://podomu.info/wp-content/uploads/a/d/8/ad8b4f8ad2e75c08a8002d03f3061397.png)



















