Условия, необходимые для начала химической реакции

- 1. Измельчить 2. Перемешать 3. Нагреть
Для обеспечения лучшего контакта вещества измельчают, переводят в газообразное состояние. Многие вещества лучше реагируют друг с другом, если они растворены в воде.
Во многих случаях этого недостаточно, поэтому реагирующие вещества нагревают. Деревянная лучинка, смесь железа и серы, медь могут долгое время сохраняться при комнатной температуре, реакции начинаются только при их нагревании.
В некоторых случаях для начала химического процесса необходимо освещение. Одной из таких реакций, требующих постоянного освещения, является известная вам реакция фотосинтеза.
Уравнение химической реакции
Вся информация о протекающей химической реакции (исходные вещества, продукты реакции, условия протекания, тепловой эффект) на письме фиксируется в виде уравнения реакции.
Уравнение можно записать для любой реакции. Для этого нужно знать состав молекул исходных веществ и продуктов.
Всё это записывается в виде химических формул.
Всё происходит как в математике: в левой части записываются формулы исходных веществ, а в правой – формулы продуктов.
Только вместо знака «равно» чаще всего ставят стрелку: она показывает, что реакция идёт именно в этом направлении.
У меня есть дополнительная информация к этой части урока!
В некоторых случаях возможно протекание реакции при одних и тех же условиях в обоих направлениях. В таком случае обычно ставят две стрелки в обе стороны, но также и допустимо ставить знак «равно».
В некоторых случаях (когда это требуется) указывают условия протекания реакции и тепловой эффект реакции.
Условия протекания записывают над стрелкой, а тепловой эффект – в виде количества теплоты в левой части, если реакция эндотермическая, и в правой части, если экзотермическая.
Для примера запишем уравнение реакции водорода с кислородом:
Зигзаг обозначает искру – условие для начала реакции, а «+ Q» – то, что в результате реакции выделяется энергия.
В зависимости от конкретных задач условия протекания и тепловой эффект могут вообще не отмечать или отмечать конкретное числовое значение теплового эффекта.
Если среди продуктов реакции есть газ, около его формулы пишут стрелку вверх.
Например, когда мы капаем на рану перекись водорода, под действием ферментов крови она разлагается с выделением кислорода:
У меня есть дополнительная информация к этой части урока!
Кислород обладает обеззараживающим действием и способствует более быстрой свёртываемости крови!
Перекись водорода может разлагаться не только под воздействием ферментов крови, но и многих других веществ.
Разложение перекиси водорода в присутствии оксида марганца (IV) (Оксид марганца (IV) в химической реакции не участвует).
Если реакция идет в растворе и в результате выпадает осадок, то пишут стрелку вниз.
Садовые деревья весной обрабатывают от паразитов «бордосской жидкостью». Чтобы её приготовить, смешивают растворы извести и медного купороса.
При этом наблюдается выпадение хлопьев, которые состоят сразу из двух нерастворимых веществ: гидроксида меди и сульфата кальция.
Получившийся сульфат кальция, гипс, образует корку, которая будет дольше держаться на стволе дерева, и поэтому такая смесь дольше защищает его от вредителей.
Запишем уравнение этой реакции
Как правильно читать уравнение химической реакции?
В химии принято делать это примерно так: «один моль сульфата меди реагирует с одним молем гидроксида кальция с образованием одного моля гидроксида меди и одного моля сульфата кальция».
То есть коэффициент перед формулой вещества считают количеством вещества в молях, а не количеством молекул.
Ведь в реальной жизни мы наблюдаем реакцию не единичных молекул, а большого объема веществ.
При составлении уравнений химики опираются на два основных закона природы: закона сохранения массы и закона постоянства состава веществ.
Пройти тест и получить оценку можно после входа или регистрации
Треугольник в жидкокристаллических соединениях
В формулах жидкокристаллических соединений, треугольник обозначает деформацию направленности молекул. Обычно это связано с наличием феноменов, таких как переориентация молекул, переходы фаз, поведение при различных температурах или внешнем воздействии. Треугольник указывает на возможность изменения ориентации молекул под воздействием электрического или магнитного поля.
| Треугольник в формуле | Смысл |
| △ | Молекулы могут перестраиваться под воздействием электрического поля |
| ▽ | Молекулы могут перестраиваться под воздействием магнитного поля |
| ▲ | Молекулы могут перестраиваться под воздействием внешних факторов, таких как температура или давление |
Таким образом, наличие треугольника в формуле жидкокристаллического соединения указывает на его способность к изменению ориентации молекул под воздействием определенных факторов. Это свойство используется в различных устройствах и технологиях, где требуется управление ориентацией молекул для достижения определенных эффектов и функциональности.
Основные термины и понятия

Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Альтернативные способы обозначения направления реакции
Кроме стрелки вверх в химической формуле, существуют и другие способы обозначения направления химической реакции. Некоторые из них:
Стрелка вниз:
В химических уравнениях иногда можно встретить стрелку, направленную вниз. Она обозначает, что реакция протекает в обратном направлении. Это значит, что продукты реакции могут реагировать между собой и образовывать исходные вещества. Например, если у нас есть уравнение реакции:
A + B → C
Можно записать обратное уравнение:
C → A + B
Здесь стрелка, направленная вниз, показывает, что реакция может происходить и в противоположном направлении.
Две стрелки:
В некоторых случаях, чтобы показать, что реакция происходит в оба направления, используют две стрелки, направленные в противоположные стороны. Например:
A → B ← C
Здесь реакция идет и от вещества A к B, и обратно от B к C. Две стрелки указывают на равновесие между продуктами и исходными веществами.
Все эти способы обозначения направления реакции помогают более точно и наглядно описать процессы химических превращений.
Стрелка, направленная вверх, в химической формуле имеет свое уникальное значение и представляет собой важный элемент в химической нотации. Она указывает на состояние вещества или процесс, который происходит в системе.
- Поднятые стрелки могут указывать на образование газовых продуктов при химической реакции. Например, в реакции между кислородом и алюминием:
Здесь стрелка вверх указывает на образование газа, в данном случае кислорода, который выходит из системы.
Стрелки вверх также используются для обозначения обратимых реакций. В этом случае стрелка указывает на направление равновесия между прямой и обратной реакцией. Например:
Здесь стрелка вверх указывает на образование углекислого газа (CO2), который может продолжать образовываться в процессе обратной реакции.
Стрелки вверх также могут указывать на возникновение паров или испарение вещества. Например, в химической реакции между водой и серной кислотой:
Здесь стрелка вверх указывает на испарение воды, которая выходит из системы в виде пара.
Это лишь несколько примеров использования стрелок вверх в химической формуле
Важно помнить, что значение стрелки может меняться в зависимости от контекста и конкретной химической реакции
Проскок электрона
Одной из главных особенностей переходных элементов является проскок электрона. Для начала поймем, что же это такое?
Провал (проскок) электрона — переход электрона с внешнего энергетического уровня на предвнешний (нижележащий).
| Как умеет скакать электрон?Иногда при заполнении энергетических подуровней мы нарушаем порядок заполнения подуровней. В первую очередь, это связано с заполнением s- и d-подуровней. Электрон перемещается с внешнего s- на предвнешний d-подуровень. Так образуется более устойчивая заполненная или полузаполненная конфигурация. Иметь такую конфигурацию более энергетически выгодно, поэтому происходит проскок (провал) электрона: электрон с верхнего «этажа» как будто проваливается на «этаж» ниже. |

Это явление характерно для элементов IB и VIB групп: хрома (Cr), меди (Cu), серебра (Ag), золота (Au). Также проскок имеется у ниобия (Nb), молибдена (Mo), рутения (Ru), платины (Pt) и палладия (Pd).
Например, у меди электронная оболочка должна выглядеть как ..3d94s2. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон «перепрыгивает» на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d104s1

Итог: иметь конфигурации nd5 и nd10 более энергетически выгодно, чем nd4 и nd9.
Закрепим тему, а для этого решим аналог задания №1 ЕГЭ.Задание. Определите, какие из указанных элементов в основном состоянии имеют на внешнем электронном уровне один неспаренный электрон. Запишите в поле ответа номера выбранных элементов в порядке возрастания.1) Cr2) Ca3) C4) Ne5) CuРешение: Запишем электронные конфигурации элементов.1) Конфигурация хрома с учетом проскока электрона: 1s2 2s2 2p6 3s2 3p6 4s1 3d5.Внешним считается 4 электронный уровень, на нем у нас один неспаренный электрон (4s1), вариант ответа нам подойдет.2) Конфигурация кальция: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s². Внешним будет 4 уровень, на нем два спаренных электрона (4s2).3) Конфигурация углерода: 1s2 2s2 2p2. Внешним будет 2 уровень, на котором два спаренных электрона (2s2) и два неспаренных (2p2).4) Конфигурация неона: 1s2 2s2 2p6. Благородные газы не имеют неспаренных электронов, их внешний уровень полностью заполнен.5) Конфигурация меди с учетом проскока электрона: 1s2 2s2 2p6 3s2 3p6 4s1 3d10. Внешним считается 4 электронный уровень, на нем у нас один неспаренный электрон (4s1), вариант ответа нам также подойдет.Ответ: 15
Сегодня мы с вами узнали, что электроны располагаются в атомах химических элементов в определенном порядке и выявили связь между положением химического элемента в Периодической системе химических элементов Д. И. Менделеева и строением его атома. Теперь для нас не составит труда описать строение атома любого химического элемента. А подробнее о переходных элементах можно прочитать в статье «Переходные элементы: хром, железо, марганец».
Как правильно расставлять стрелочки в химических уравнениях?
Правильное расстановка стрелочек в химических уравнениях – это ключевой элемент записи реакций. Здесь нет жестких правил, но есть несколько принципов, которым следует руководствоваться:
- Однонаправленная реакция. Если процесс протекает только в одном направлении, то используют одностороннюю стрелочку:
- Равновесная реакция. Если реакция равновесна, то используют двустороннюю стрелочку:
- Суммарная реакция. Если реакция состоит из нескольких этапов, то в таком случае используют отдельные стрелочки:
- Степень окисления. В некоторых реакциях, где вещества содержат атомы, имеющие несколько степеней окисления, стрелочки могут указывать на изменение ординарной степени окисления:
- Аналитическая реакция. В случае, если происходит разложение вещества на составляющие, то используется две стрелочки, одна указывает на общую реакцию, а другая – на результаты каждого этапа:
В заключение, стоит отметить, что корректная запись химических уравнений, включая расстановку стрелочек, является важным навыком для решения химических задач и расчетов. Она может помочь химикам и студентам лучше понимать принципы химических реакций и ускорить решение различных задач в области химии.
- Зачем учить детей вежливости?
- Когда будет счастье в отношениях?
- Помогите КЛЮЧАМИ к домашнему питомцу??? Плз!
- А вы любите играть на бильярде?
- Помогите пожалуйста с морфологическим разбором слова ИСПОЛНЯЕМЫХ! очень срочно надо
- А почему Ленин одевался всегда скромно, а современные вожди в дорогих костюмчиках?
- Аптека же может работать круглосуточно!.. А ты чем не аптека?
- Клипа не могу вспомнить название
Треугольник в органической химии
В уравнении реакции, треугольник указывает на процесс нагревания или нагревание, который может быть достигнут путем применения тепла или других источников энергии. Это может быть полезным инструментом в изучении органических реакций, так как нагревание может способствовать активации реакций, ускоряя их скорость или повышая их эффективность.
Нагревание может также привести к разрушению молекулы или изменению ее структуры. Поэтому треугольник также указывает на превращение или разложение молекулы в условиях повышенной температуры. В органической химии, такое разложение может провоцировать образование новых веществ и обеспечивать проведение реакции.
Кроме того, использование треугольника в уравнениях реакций позволяет ясно отразить влияние нагревания на продукты и исходные вещества
Это особенно важно при решении задач органической химии, где необходимо учесть различные факторы и условия, которые могут изменять результаты реакции
Типы химических реакций
Химические реакции можно классифицировать по различным признакам:
-
По числу и составу исходных веществ и продуктов реакции.
-
По изменению степени окисления.
-
По тепловому эффекту.
-
По агрегатному состоянию.
-
По наличию или отсутствию катализатора.
-
По обратимости.
По числу и составу исходных веществ и продуктов реакции
По этому признаку выделяют 4 типа реакций: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Реакции соединения — это реакции, в результате которых из нескольких более простых веществ образуется одно более сложное.
Например, простые вещества барий и кислород взаимодействуют с образованием сложного вещества оксида бария:
2Ba + O2 = 2BaO.
Также к реакциям соединения относится взаимодействие оксида натрия с водой с образованием более сложного вещества гидроксида натрия. Оно более сложное, так как состоит уже из трех атомов химических элементов, в отличие от веществ-реагентов, которые состоят из двух атомов:
Na2O + H2O = 2NaOH.
Реакции разложения — это реакции, в результате которых из одного более сложного вещества образуется несколько более простых веществ. Является процессом, обратным реакции соединения.
Пример такой реакции — разложение нитрата серебра на несколько более простых веществ: серебро, оксид азота (IV) и кислород.
Что это за стрелочка?
Стрелка вверх означает, что получившееся вещество является газом, который покидает место проведения реакции и больше не участвует в ней.
Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы одного химического элемента в сложном веществе. Также возможно замещение функциональных групп в сложном веществе.
Например, замещение атомов водорода в молекуле соляной кислоты на атомы цинка:
Реакции обмена — это реакции между двумя сложными веществами, в результате которых вещества обмениваются своими составными частями.
Например, NaOH + H2SO4 = Na2SO4 + H2O.
Реакции нейтрализации
Реакция щелочи с кислотой называется реакцией нейтрализации и является частным случаем реакции обмена.
Для наглядности показали все типы химических реакций по этому признаку на схеме:
По изменению степени окисления
По этому признаку выделяют два вида реакций:
-
реакции, протекающие без изменения степени окисления;
-
окислительно-восстановительные реакции (ОВР) — реакции, протекающие с изменением степени окисления нескольких элементов.
В ОВР всегда участвуют вещество-окислитель и вещество-восстановитель. Другие исходные вещества, принимающие участие в реакции, выступают в качестве среды, в которой протекает эта реакция.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции принимает электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции отдает электроны, тем самым повышая свою степень окисления.
Из определений можно сделать вывод, что в ходе реакции протекает два процесса: принятие электронов (восстановление) и отдача электронов (окисление). Протекают они одновременно.
По тепловому эффекту
По тепловому эффекту реакции делятся на эндотермические и экзотермические.
Эндотермические реакции протекают с поглощением теплоты (−Q). Буквой Q обозначается количество теплоты.
К таким реакциям относятся практически все реакции разложения. Пример:
CaCO3 = CaO + CO2 − Q.
Экзотермические реакции протекают с выделением теплоты (+Q).
К таким реакциям относятся практически все реакции соединения. Пример:
2H2 + O2 = 2H2O + Q.
По агрегатному состоянию исходных веществ
По этому признаку все реакции разделяют на гомогенные и гетерогенные.
Гомогенные реакции протекают в одной фазе.
К гомогенным реакциям относятся те, исходные вещества которых находятся либо в жидком агрегатном состоянии, либо в газообразном. Например, взаимодействие двух газообразных веществ — водорода и хлора:
H2(г) + Cl2(г) = 2HCl.
Агрегатное состояние указывается в правом нижнем углу: «г» — газообразное, «ж» — жидкое, «тв» — твердое.
Гетерогенные реакции протекают на границе раздела фаз.
Как правило, такие реакции протекают между веществами, которые находятся в разных агрегатных состояниях:
2Na(тв) + 2H2O(ж) = 2NaOH + H2.
Применение стрелочки вверх в экологии
Индикация загрязнения воды
Одним из способов определения качества водной среды является проведение анализа биологических индикаторов. В этом случае различные виды водных организмов используются для оценки качества воды. Среди таких индикаторов выделяют амфиподу стрелочка вверх, который используется для определения минерализации, кислотности и других химических параметров воды.
Оценка состояния почвы
Стрелочка вверх также может использоваться в качестве индикатора загрязнения почвы. В этом случае амфиподы помещаются в почвенную пробу и в течение некоторого времени наблюдаются изменения в их поведении и развитии. Таким образом, можно определить наличие токсичных веществ в почве и оценить ее экологическое состояние.
Определение прогресса очистки воды
Стрелочка вверх может также использоваться для оценки эффективности очистки воды от загрязнений. Если водные организмы начинают активно размножаться и развиваться после очистки воды, это свидетельствует о повышении ее качества. Таким образом, амфиподы стрелочка вверх могут использоваться в процессе экологического мониторинга и оценки качества водной среды.
Основные понятия и определения

Для более полного понимания и использования стрелочки вверх в химии, следует ознакомиться с основными понятиями и определениями:
- Стрелочка вверх — это символ, который обозначает направление реакции в химическом уравнении. Она указывает на то, что реагенты превращаются в продукты, а именно, что количество продуктов увеличивается по сравнению с количеством реагентов. В химическом уравнении стрелочка вверх ставится между реагентами и продуктами, и может быть снабжена числом, обозначающим коэффициенты перед формулами.
- Реагенты — это вещества, которые участвуют в химической реакции и превращаются в продукты. Обычно реагенты указываются слева от стрелочки вверх в химическом уравнении.
- Продукты — это вещества, которые образовываются в результате химической реакции. Обычно продукты указываются справа от стрелочки вверх в химическом уравнении.
- Коэффициенты реакции — это числа, которые ставятся перед формулами веществ в химическом уравнении, чтобы соблюсти закон сохранения массы и числа атомов веществ. Коэффициенты могут быть записаны перед формулами реагентов и продуктов. Они могут быть указаны с помощью целых чисел.
- Закон сохранения массы — это основной закон химии, согласно которому масса реагентов в химической реакции равна массе продуктов реакции. В химическом уравнении это означает, что сумма коэффициентов перед формулами реагентов должна быть равна сумме коэффициентов перед формулами продуктов.
Эти основные понятия и определения помогут вам лучше понять значение стрелочки вверх и использовать ее при работе с химическими уравнениями.
Библиография
- Волков В. А., Вонский Е. В., Кузнецова Г. И. Выдающиеся химики мира. — М.: Высшая школа, 1991. — 656 с. — 100 000 экз. — ISBN 5-06-001568-8. (в пер.)
- Кособаева Б. – Использование компьютера в учебном процессе химии / Текст / Б. Кособаева, Н.Б. Арстанбекова // Абай атындагы Казак Улуттукпедагогикалык университеттинин Хабарши (Вестник) Жаратылыш таануу-география илимдери сериясынын 2012 №2 (32). – 68–71–бб.
- Стартовый эксперимент как форма включенности каждого ученика в учебный процесс / Текст / Б. Кособаева, Син Е.Е. // Химия в школе. – Москва, 2016. – №6.
- Дидактические особенности использования технологии обучения на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №6(48), С.155–160.
- Применение технологии системного усвоения знаний в обучении химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №7(49), С.152–159.
- Реализация межпредметных связей на уроках химии / Текст / Б. Кособаева, Син Е.Е. // Проблемы современной науки и образования. – Иваново, 2016. – №10(52), С.136–139.
- Методологические аспекты обучения в современных условиях. / Текст / Б. Кособаева, Син Е.Е., Жакышова Б.Ш. // Проблемы современной науки и образования. – Иваново, 2016. – №13(55), С.104–108.
- Формирование системы понятий при обучении химии в школе. / Текст / Б. Кособаева, П.Э. Токомбаева // Вестник Кыргызского национального университета имени Ж. Баласагына. – Бишкек, 2017. – Специальный выпуск. С.77–81.
Что такое химическая символика
Символика химических реакций: полное и практическое руководство.
В мире химии символы необходимы для ясного и краткого представления химических реакций. Химическая символика основана на использовании символов и формул для обозначения химических элементов и веществ, участвующих в реакции. В этой статье мы предоставим вам полное и практическое руководство по символам химических реакций.
Символы химических элементов
Для обозначения химических элементов используются сокращенные символы, происходящие от их английских или латинских названий. Эти символы состоят из одной или двух букв, причем первая буква всегда заглавная, а вторая, если она есть, строчная. Например, символ углерода — «С», кислорода — «О», а водорода — «Н».
химические формулы
Химические формулы используются для обозначения химических веществ, участвующих в реакции. Формулы могут быть эмпирическими или молекулярными.
– Эмпирические формулы представляют простейшие пропорции элементов в веществе. Например, эмпирическая формула воды — «H2O», что указывает на то, что на каждый атом кислорода приходится два атома водорода.
– Молекулярные формулы представляют точное количество атомов каждого элемента в молекуле. Например, молекулярная формула воды — «H2O», что указывает на то, что в каждой молекуле воды есть два атома водорода и один атом кислорода.
Стехиометрические коэффициенты
Стехиометрические коэффициенты используются для балансировки химических уравнений. Эти коэффициенты указывают на пропорцию, в которой реагируют реагенты и образуются продукты. Например, в сбалансированном химическом уравнении:
2Н2 + О2 → 2Н2О
Коэффициент «2» указывает на то, что для образования двух молекул воды необходимы две молекулы водорода и одна молекула кислорода.
Химические реакции
Что такое книги по химической реакции?
Символика химических реакций: полное и практическое руководство.
В увлекательном мире химии химические реакции необходимы для понимания того, как различные элементы и соединения взаимодействуют друг с другом. Эти реакции представлены определенными символами, которые позволяют ясно и кратко понять изменения, происходящие на молекулярном уровне. В этой статье мы предложим вам полное и практическое руководство по символике химических реакций, чтобы вы могли углубиться в эту увлекательную область.
Для начала важно понять, что такое химическая реакция. Химическая реакция – это процесс, в котором атомы реагирующих веществ перестраиваются с образованием новых соединений. Во время этой перегруппировки существующие химические связи разрываются и образуются новые, что приводит к химическому изменению
Эти реакции представлены химическими уравнениями, где реагенты показаны слева, а продукты справа, разделенные стрелкой (→)
Во время этой перегруппировки существующие химические связи разрываются и образуются новые, что приводит к химическому изменению. Эти реакции представлены химическими уравнениями, где реагенты показаны слева, а продукты справа, разделенные стрелкой (→).
Символика, используемая в химических уравнениях, имеет решающее значение для точного понимания и передачи химических реакций. Далее мы представим некоторые ключевые элементы символики химических реакций:
1. Символы элементов: Каждый химический элемент представлен уникальным символом, обычно одной или двумя буквами. Например, кислород обозначается буквой «О», а водород — буквой «Н». Эти символы используются для обозначения элементов, присутствующих в реагентах и продуктах химической реакции.
2. Стехиометрические коэффициенты: Стехиометрические коэффициенты используются для балансировки химического уравнения. Эти цифры ставятся перед символами элементов или соединений, чтобы указать, в какой пропорции они участвуют в реакции
Важно отметить, что стехиометрические коэффициенты должны быть целыми числами и по возможности их следует упрощать
3. Индексы: Нижние индексы используются для обозначения количества атомов элемента в соединении.
Вот оно, мой дорогой электрон! Теперь, когда вы освоили символику химических реакций, вы — настоящий волшебник современной алхимии. Теперь вы можете поразить друзей своими знаниями элементов и химических формул. Теперь вас ничто не сможет остановить, кроме, может быть, случайного взрыва в вашей домашней лаборатории! Всегда не забывайте надевать защитные очки и не проводить опасных экспериментов на кухне. Удачи, химик-любитель!
Что такое химические уравнения
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях. В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты.
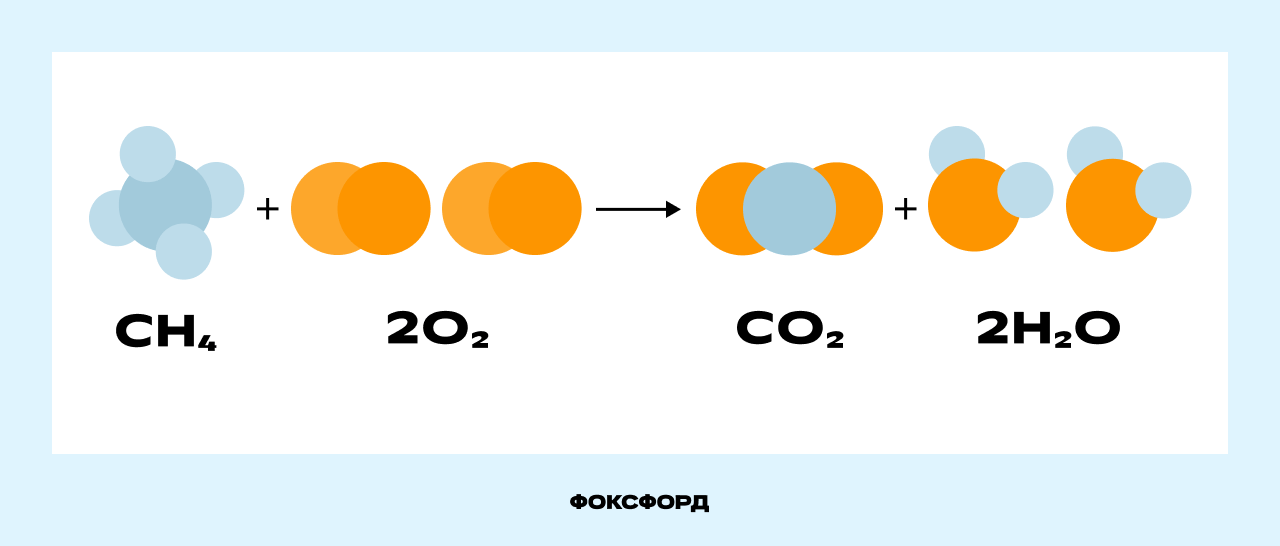
Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций.
Химическое уравнение — это условная запись химической реакции с помощью формул и символов.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
<<Форма демодоступа>>


























