Структура Периодической системы Д. И. Менделеева
В Периодической системе каждому элементу отведена отдельная клетка с определенным номером. Смысл данного номера вы изучите далее.
Периоды
Как мы упоминали ранее, таблица Менделеева похожа на многоквартирный дом, каждая клетка химического элемента – это «квартира». «Квартиры» строго распределены по «этажам», которые называются периоды.
Периодическая система химических элементов по горизонтали делится на семь периодов:
- 1 период состоит из двух элементов: $Н$ водород и $Не$ гелий;
- 2 период начинает с $Li$ лития и заканчивается $Ne$ неоном;
- 3 период начинается с $Na$ натрия и заканчивается $Ar$ аргоном.
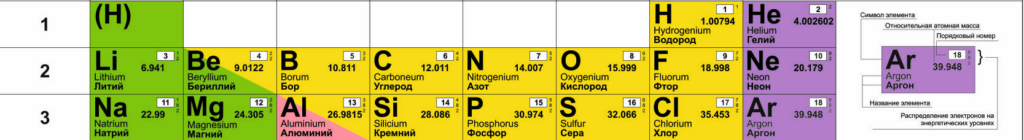
Рисунок 2 — Малые периоды
Первые три периода состоят из одного ряда, поэтому называются малыми периодами.
4, 5, 6 и 7 периоды состоят из двух рядов элементов и называются большими периодами.

Рисунок 3 — Большие периоды
На «подвальных этажах» расположились 14 элементов, схожих по своим свойствам одни на $Ac$ актиний, другие на $La$ лантан.

Рисунок 3 — Лантаноиды и актиноиды
{"questions":}}}]}
Группы
Химические элементы, схожие по свойствам, располагаются в вертикальных столбцах – группах, их в таблице Д. И. Менделеева восемь.
Каждая из групп состоит из подгрупп – главной и побочной.
Главная подгруппа (группа А) – подгруппа, в которую входят элементы малых и больших периодов.
Побочная подгруппа (группа В) – подгруппа, в которую входят элементы только больших периодов.
К главной подгруппе I группы (IA группы) относятся литий, натрий, калий, рубидий, цезий и франций; к побочной подгруппе I группы (IB группы) относятся медь, серебро и золото.
{"questions":,"items":}}}]}
Как 33 буквы русского алфавита складываются в сотни тысяч слов, так и 118 химических элементов соединяются между собой и создают миллионы разных веществ.
{"questions":}}}]}
Чтобы вам было легче погрузиться в мир химических формул и уравнений химических реакций, выучите символы химических элементов. Некоторые, наиболее базовые, представлены ниже в таблице.
Начните изучение с них, а затем и все знаки таблицы Д. И. Менделеева крепко закрепятся в вашей памяти.
| Название химического элемента | Химический знак | Произношение химического знака |
| Азот | $N$ | Эн |
| Алюминий | $Al$ | Алюминий |
| Водород | $H$ | Аш |
| Железо | $Fe$ | Феррум |
| Калий | $K$ | Калий |
| Кальций | $Ca$ | Кальций |
| Кислород | $O$ | О |
| Кремний | $Si$ | Силициум |
| Магний | $Mg$ | Магний |
| Марганец | $Mn$ | Марганец |
| Медь | $Cu$ | Купрум |
| Натрий | $Na$ | Натрий |
| Сера | $S$ | Эс |
| Серебро | $Ag$ | Аргентум |
| Углерод | $C$ | Цэ |
| Фосфор | $P$ | Пэ |
| Хлор | $Cl$ | Хлор |
| Цинк | $Zn$ | Цинк |
Таблица 1 — Названия некоторых химических элементов
ЗАДАНИЕ
Пользуясь словарями (этимологическим, энциклопедическим и химических терминов), назовите важнейшие свойства, которые отражены в названиях химических элементов: бром $Br$, азот $N$, фтор $F$.
Показать ответ
Скрыть ответ
Бром $Br$ – из древне-греческого brome, «зловоние», «вонючий». $Br_2$ – это едкая жидкость красно-бурого цвета с очень неприятным запахом.
Азот $N$ – из греческого azoos, «безжизненный». $N_2$ – инертный газ, не поддерживающий горение.
Фтор $F$ – из греческого phthoros, «вред», «разрушение». Это чрезвычайно активный газ желто-зеленого цвета.
Поддержать промышленность
В 1882 году готовится первый в России торгово-промышленный съезд, который мог оказать влияние на формирование экономической программы Александра III, только что вступившего на престол. Менделеев пишет: «Царь, который позаботится устроить все условия для развития заводского и фабричного дела и для сбыта русских заводских и фабричных продуктов на запад и на восток, займет еще более славное место в истории России». На съезде он выступает с программой «Об условиях развития заводского дела», обращается к правительству с требованием организации льготного кредитования промышленных начинаний и петицией о необходимости создания министерства промышленности. Удивительно, что через полтора столетия после этой записки России приходится решать те же проблемы.
«Я не был и не буду ни фабрикантом, ни заводчиком, ни торговцем, но я знаю, что без них, без придания им важного и существенного значения нельзя думать о прочном развитии благосостояния России»
Менделеев был активным поборником индустриализации России. В статье о Всероссийской выставке 1896 года он писал: «Там впереди… усиление мирового значения России и торжество русского гения на пути промышленного прогресса, а вместе с тем богатство и могущество русского народа».
Дмитрий Иванович считал важным поддерживать не только промышленность, но и промышленников
Как он писал, «я не был и не буду ни фабрикантом, ни заводчиком, ни торговцем, но я знаю, что без них, без придания им важного и существенного значения нельзя думать о прочном развитии благосостояния России».. На службу индустриализации России великий ученый поставил не только свой гений естествоиспытателя и изобретателя, не только выдающиеся экономические познания, но и свое перо публициста и общественный авторитет
Он неоднократно обращался с письмами по вопросам промышленного развития страны к Александру III, Николаю II, многим высокопоставленным царским сановникам, собирался издавать газету, основной целью которой считал развитие начал протекционистской политики — ей он посвятил три письма Николаю II. Письма эти были написаны в 1897, 1898 и 1901 годах по просьбе министра финансов Сергея Витте, который говорил, что он один не в силах убедить царя.
На службу индустриализации России великий ученый поставил не только свой гений естествоиспытателя и изобретателя, не только выдающиеся экономические познания, но и свое перо публициста и общественный авторитет. Он неоднократно обращался с письмами по вопросам промышленного развития страны к Александру III, Николаю II, многим высокопоставленным царским сановникам, собирался издавать газету, основной целью которой считал развитие начал протекционистской политики — ей он посвятил три письма Николаю II. Письма эти были написаны в 1897, 1898 и 1901 годах по просьбе министра финансов Сергея Витте, который говорил, что он один не в силах убедить царя.

В своём отчёте С. Ю. Витте Д. И. Менделеев пишет: «истинное развитие промышленности немыслимо без свободного соревнования мелких и средних заводчиков с крупными». Кушвинский завод. 1899 год
Wikipedia
Строение периодической системы
Для начала рассмотрим понятия таблица и система. Вы не один раз видели таблицу, она состоит из строк и столбцов. Но почему творение Менделеева имеет названия как таблица, так система да еще и с добавлением периодическая.
В таблице содержится упорядоченная информация в определённом порядке. Система указывает, что сведения связаны между собой. Периодичность означает, что через какой-то промежуток или отрезок происходит повторение свойств.
Как уже известно, в периодической системе находятся элементы. Принцип их расположения — это увеличение их атомной массы.
В таблице имеются строки – это периоды, и столбцы – группы.
Существует несколько вариантов ПСХЭ, так называемый короткий и длинный вариант.
Короткий вариант имеет 8 групп, номера которых указаны римскими цифрами I, II…VIII, содержит главную (А) и побочную (В) группы. Длинный формат вмещает 18 групп, нумерация осуществляется арабскими цифрами I, II…XVIII,
Если посмотреть на таблицу, то видим закономерность, так как абсолютно каждый период будет начинаться активным металлом и заканчиваться инертным газом. Такая периодичность сохраняется 7 раз.
Как видно из таблицы, I период включает 2 элемента, II и III состоят из 8, IV и V содержат 18, самые большие – это VI и VII вмещают 32 элемента (VII период незаконченный).
В периоде с ростом атомной массы металлические свойства уменьшаются, неметаллические – увеличиваются.
Вертикальные столбцы образуют группы. Это условно компании, где собираются единомышленники. Точнее, располагаются элементы, подобные по своим свойствам.
Обратите внимание, что подобие характерно только в пределах подгруппы. Так, натрий и медь принадлежат одной I группе, но располагаются в разных подгруппах. Натрий – элемент главной подгруппы, медь – побочной
Именно по этой причине они будут иметь разные физические и химические свойства
Натрий – элемент главной подгруппы, медь – побочной. Именно по этой причине они будут иметь разные физические и химические свойства.
В пределах группы с ростом атомной массы металлические свойства увеличиваются, неметаллические – уменьшаются.
Таким образом, периодическую систему можно условно назвать домом химических элементов, где каждый из них занимает своё определённое место (порядковый номер) согласно его свойствам.
Рассмотрим подробнее на примере 2 и 3 периода. Что показывает сравнение: оба периода начинаются с активных металлов Li и Na, для которых характерно существование в виде соединений, в свободном виде могут находиться только под слоем керосина. Они относятся к группе щелочных металлов. Анализируя схему, мы видим, что первые три группы образованны металлами. С IV – VII находятся неметаллы. «Закрывают период» инертные газы.
Особое внимание располагают к себе элементы VI и VII периоды, которые образуют «семейство» лантаноидов (Лантан № 57) и актиноидов (Актиний 89), они формально близки к скандию. Но из-за их количества они вынесены за пределы системы
Как изменяются свойства элементов в Периодической таблице
Свойства элемента иногда классифицируются либо как химические, либо как физические. Химические свойства обычно наблюдаются в ходе химической реакции, в то время как физические свойства наблюдаются при исследовании образца чистого элемента. Химические свойства элемента обусловлены распределением электронов вокруг ядра атома, особенно внешних, или валентных, электронов; именно эти электроны участвуют в химических реакциях. Химическая реакция не влияет на атомное ядро; поэтому атомный номер остается неизменным в химической реакции.
Некоторые свойства элемента можно наблюдать только в совокупности атомов или молекул этого элемента. Эти свойства включают цвет, плотность, температуру плавления, температуру кипения, а также тепловую и электрическую проводимость. В то время как некоторые из этих свойств обусловлены главным образом электронной структурой элемента, другие более тесно связаны со свойствами ядра, например, массовым числом.
Примечание 2
Элементы иногда группируются в соответствии с их свойствами. Одна из основных классификаций элементов — металлы, неметаллы и металлоиды. Элементы с очень похожими химическими свойствами часто называют семействами; некоторые семейства элементов включают галогены, инертные газы и щелочные металлы. В периодической таблице элементы расположены в порядке возрастания атомного веса таким образом, что элементы в любом столбце обладают схожими свойствами.
Тенденции периодической таблицы
Понимание периодического изменения энергии ионизации, сродства к электрону, электроотрицательности, свойств кислот и оснований, числа окисления в окислительно-восстановительной реакции химических элементов являются очень важными характеристиками для любого обсуждения или информации в химии или науке. При изучении химии мы суммируем физические и химические свойства по группам и периодам.
Когда мы двигаемся вниз в группе, размер и электроположительный характер атомов увеличиваются. Энергия ионизации обычно уменьшается, но во многих случаях увеличивается из-за экранирования электронов или эффективных ядерных зарядов. У нижнего элемента кристаллических твердых металлов, таких как серебро (Ag), золото (Au), кадмий (Cd) и ртуть (Hg), энергия ионизации увеличивается. Электроотрицательность и сродство к электрону обычно уменьшаются, но иногда наблюдаются некоторые исключения. Тенденция сродства к электрону химического элемента второго ряда периодической таблицы обычно ниже, чем у третьего ряда.
Периодическая таблица с электронной конфигурацией
Пара элементов расположена по диагонали друг к другу в таблице периодов, чтобы описать простое соотношение или химические свойства, такие как электрическая поляризация содержимого в химии. Диагональная пара, такая как бериллий и алюминий, имеет аналогичное соотношение изменения / размера, поскольку размер увеличивается с меньшим периодом, в то время как заряд увеличивается вправо, но это правило не может работать полностью для всех элементов периодической таблицы.
Интересные факты в периодической таблице Менделеева, объясняющие общую связь между электронной структурой и периодическим размещением, предназначением химических элементов в краткой форме. Например, орбиталь 1s может иметь только два электрона, следовательно, период один содержит только два элемента. Период-VI включает 6s, 4f, 5d и 6p орбитали в электронной структуре валентной оболочки с общим количеством (2 + 14 + 10 + 6) = 32 элемента от цезия до радона. Упрощенная научная формула в химии используется для вычисления количества химических элементов в каждом периоде семейств периодической таблицы Менделеева.
Интересные факты
В те времена не только заниматься химией было не популярно, но и большинство людей считали это занятие сродни колдовству или вовсе преступлением. Поэтому в свое время деятельность Менделеева обросла большим количеством легенд. Одна из них, которая считается наиболее популярной, гласит о том, что периодическая система Менделеевым была открыта, когда ученому она просто приснилась.

Такие случаи в истории не были едиными, такие же слухи ходили относительно многих научных открытий. Но эта гипотеза была опровергнута самим Менделеевым, который указывал на то, что он работал над созданием таблицы несколько десятков лет.
Еще одна не менее популярная история гласит о том, что Менделеев был изобретателем водки. Связано это было с его диссертационной работой, в которой он рассуждал на тему смеси воды и спирта. Современники часто подшучивали над ним на эту тему, а уже следующие поколения были точно уверены – именно Менделеев и является первооткрывателем этого напитка.
Ходили слухи и о том, что Менделеев оборудовал свою лабораторию в дупле дуба. Нередко звучали шутки и относительно любительского хобби ученого – плетения чемоданов. Часто даже звучало прозвище Чемоданных дел мастер.
Переоценить вклад этого великого ученого в историю развития химической науки невозможно. Ему обязаны не только выведением общего закона для всех элементов, существующих в природе, но и дальнейшими исследованиями. Опираясь на данные Менделеева, ученые проводили все больше экспериментов, пытаясь не только найти но и синтезировать недостающие элементы для изучения их свойств.
Претенденты на лидерство
Французы больше склоняются к своему земляку Александру Эмилю Бегуйе де Шанкуртуа. Свою систематизацию химических элементов этот ученый вывел еще в 1862 году, то есть за 9 лет до Менделеева. Периодическую систему французского химика назвали «земной спиралью» или «цилиндром Бегуйе».
Англичане предпочитают отмечать заслуги Уильяма Одлинга и Джона Александра Рейна Ньюлендса. Оба ученых предприняли попытки систематизировать химические элементы в 1864 году. Уильям Одлинг изобрел таблицу, с которой, кстати, был знаком и Менделеев и не скрывал этого. Дмитрий Иванович признавал, что в системе Одлинга есть «зачатки» его Периодического закона.
Ньюлендс назвал свою таблицу химических элементов «системой октав». Однако через 2 года англичанин забросил научную деятельность и больше не занимался усовершенствованием своей системы.
В том же 1864 году другой ученый, только уже из Германии, Юлиус Лотар Мейер обнародовал свою периодическую таблицу. Интересно, что в 1882 году и Менделеев, и Мейер получили по золотой медали «За открытие периодических соотношений атомных весов». Хотя Менделеев утверждал, что немецкий исследователь «не имел в виду периодического закона», и вообще ничего нового в него не привнес.
Понятие валентности
article>ÐаленÑноÑÑÑ â ÑÑо ÑпоÑобноÑÑÑ Ð°Ñома ÑимиÑеÑкого ÑлеменÑа обÑазовÑваÑÑ Ð¾Ð¿Ñеделенное ÑиÑло ÑимиÑеÑÐºÐ¸Ñ ÑвÑзей Ñ Ð´ÑÑгими аÑомами.
РаÑÑмоÑÑим ÑÑÑÑкÑÑÑнÑÑ ÑоÑмÑÐ»Ñ H2SO4, Ñ Ð¿Ð¾Ð¼Ð¾ÑÑÑ ÐºÐ¾ÑоÑой можно опÑеделиÑÑ, как аÑÐ¾Ð¼Ñ ÑвÑÐ·Ð°Ð½Ñ Ð¼ÐµÐ¶Ð´Ñ Ñобой в веÑеÑÑве:
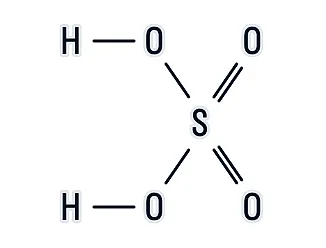
ÐÑÑÐ¾Ð´Ñ Ð¸Ð· ÑÑÑÑкÑÑÑÑ, можно ÑделаÑÑ Ð²ÑводÑ:
-
аÑÐ¾Ð¼Ñ Ð²Ð¾Ð´Ð¾Ñода H имеÑÑ Ð¾Ð´Ð½Ñ ÑимиÑеÑкÑÑ ÑвÑзÑ, Ñо еÑÑÑ Ð¾Ð´Ð½Ð¾Ð²Ð°Ð»ÐµÐ½ÑнÑ;
-
ÑеÑа S Ð¸Ð¼ÐµÐµÑ ÑеÑÑÑ ÑимиÑеÑÐºÐ¸Ñ ÑвÑзей, Ñо еÑÑÑ ÑеÑÑиваленÑна;
-
каждÑй аÑом киÑлоÑода O Ð¸Ð¼ÐµÐµÑ Ð´Ð²Ðµ ÑимиÑеÑкие ÑвÑзи â двÑÑваленÑен.
ÐаленÑноÑÑÑ Ð¾Ð±Ð¾Ð·Ð½Ð°ÑаеÑÑÑ ÑимÑкой ÑиÑÑой над знаком ÑимиÑеÑкого ÑлеменÑа в ÑоÑмÑле. ÐапÑимеÑ:

ÐÑом наÑÑÐ¸Ñ Ð¸Ð¼ÐµÐµÑ Ð²Ð°Ð»ÐµÐ½ÑноÑÑÑ, ÑавнÑÑ 1, а аÑом киÑлоÑода â ÑавнÑÑ 2.

Таблица Менделеева с выделением главных и побочных подгрупп
Элементы главных подгрупп обозначены фиолетовым цветом, побочных — серым. Я напоминаю, что свойства элементов, находящихся в одной группе, но в разных подгруппах, отличаются достаточно сильно.
Например, натрий, калий, медь и серебро находятся в I группе: Na и K — в главной подгруппе, Cu и Ag — в побочной. Свойства натрия и калия весьма похожи — активные металлы, бурно реагирующие с водой, легко окисляющиеся на воздухе, имеют низкие температуры плавления и кипения. Все это сильно отличается от свойств меди и серебра: инертные металлы, которые не реагируют не только с водой, но и с большинством кислот, на воздухе устойчивы, температуры плавления и кипения достаточно высоки.
Еще ярче отличия заметны, например, в VI группе. Кислород, сера, селен (главная подгруппа) — типичные неметаллы, а хром, молибден и вольфрам, находящиеся в побочной подгруппе, относятся к металлам.
Все проблемы исчезают, если вы используете таблицы Менделеева: «мешанина» из элементов главных и побочных подгрупп исчезает, и мы начинаем отчетливо видеть логику периодического закона.
| Периоды | Группы элементов | |||||||||
| I | II | III | IV | V | VI | VII | VIII | |||
| 1 |
1 |
1 |
2 |
|||||||
| 2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
||
| 3 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
||
| 4 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
|
29 |
30 |
31 |
32 |
33 |
34 |
35 |
36 |
|||
| 5 |
37 |
38 |
39 |
40 |
41 |
42 |
43 |
44 |
45 |
46 |
|
47 |
48 |
49 |
50 |
51 |
52 |
53 |
54 |
|||
| 6 |
55 |
56 |
57 |
72 |
73 |
74 |
75 |
76 |
77 |
78 |
|
79 |
80 |
81 |
82 |
83 |
84 |
85 |
86 |
|||
| 7 |
87 |
88 |
89 |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
| Высшие оксиды | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | ||
| Водородные соед. | RH4 | RH3 | H2R | HR |
| *Лантаноиды |
58 |
59 |
60 |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 |
| ^Актиноиды |
90 |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
102 |
103 |
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д. И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
<<Форма демодоступа>>
Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит чуть иначе.
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.

Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов, теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил. Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ей пользоваться.
<<Форма семейного образования>>
Ориентир – франций
Для начала изучим свойства элементов, которые увеличиваются справа налево и сверху вниз при движении по таблице (т.е. при движении к францию – Fr).
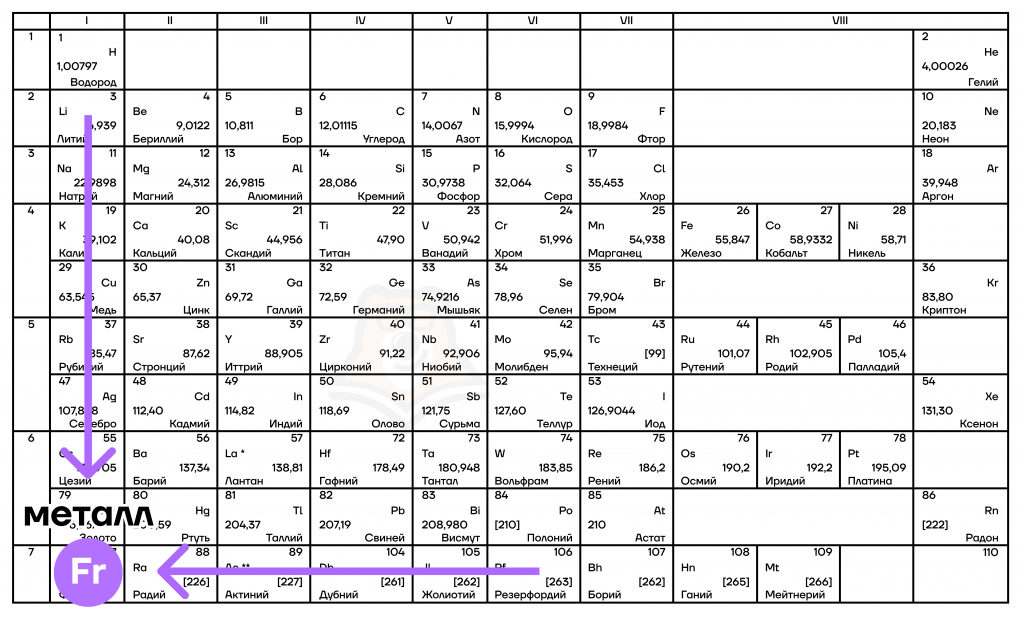
Металлические/восстановительные свойства
Вообще, под металлическими свойствами подразумевают способность атомов отдавать электроны. Можно провести воображаемую линию, которая начинается у атома бора и заканчивается у атома астата. Так вот, все элементы, которые попадут в левую область таблицы будут являться , а элементы главных подгрупп, которые попадут в правую часть — . Поэтому металлические/восстановительные свойства в периодах увеличиваются справа налево, а в группах — сверху вниз.
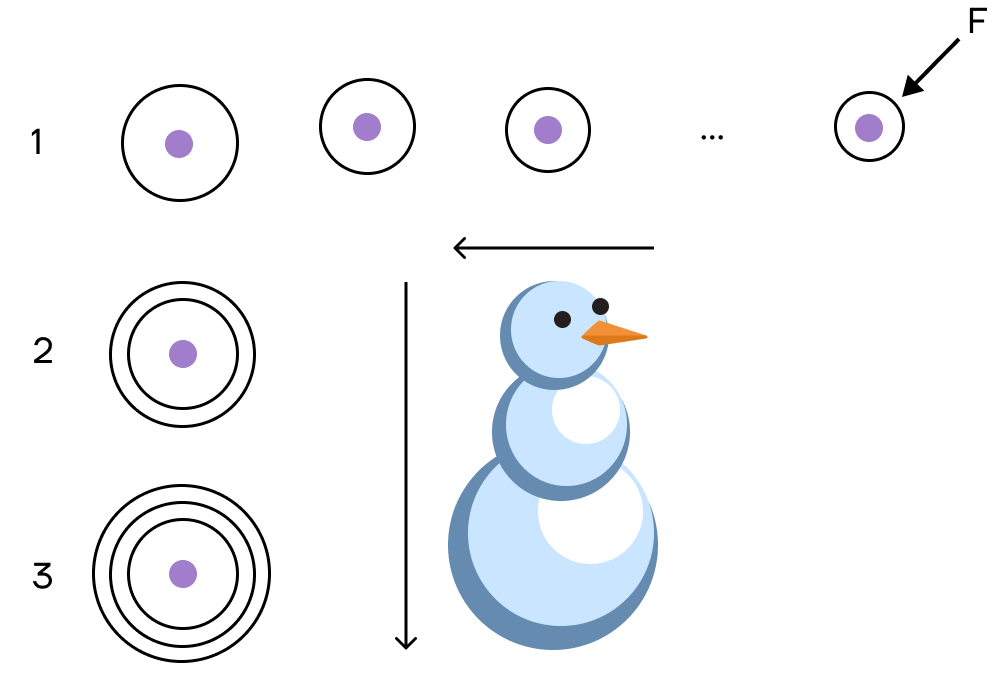
Радиус атома
При движении по периоду увеличивается число электронов на соответствующем валентном уровне — электроны начинают сильнее притягиваться к положительному ядру, тем самым «сжимая» размер радиуса. Поэтому радиус атома уменьшается слева направо при движении по периоду.
При движении по группе сверху вниз увеличивается число электронных оболочек, атом становится «толще», поэтому сверху вниз по группе радиус атома увеличивается.
При сравнении элементов ориентируемся снова на франций: какой атом ближе к нему, у того радиус больше.
| Как связаны снеговик и радиус атома?С увеличением номера периода количество электронных слоев растет, а значит, увеличивается и радиус атома. Но так как к фтору увеличивается электроотрицательность, то электроны все ближе и ближе «прижимаются» к ядру атома: атомный радиус уменьшается.Проще всего это представить в виде снеговика, у которого самая «маленькая» голова и самое «большое» туловище. Именно так увеличивается радиус ядра атома по группе. |
Основные свойства высших оксидов/гидроксидов
Основные свойства характеризуют способность соединений реагировать с кислотами, они зависят от металлических свойств и меняются точно так же: в периодах увеличиваются справа налево, а в группах — сверху вниз.
Структура периодической системы
Периодическая система химических элементов Д. И. Менделеева является графическим отражением его же закона. Элементы расположены в таблице по определенному химическому и физическому смыслу. По расположению элемента можно определить его валентность, число электронов и многие другие особенности. Таблица поделена горизонтально на большие и малые периоды, а вертикально на группы.
Рис. 2. Таблица Менделеева.
Существует 7 периодов, которые начинаются с щелочного металла, а заканчиваются веществами, имеющими неметаллические свойства. Группы, в свою очередь, состоящие из 8 столбцов, поделены на главные и побочные подгруппы.
Дальнейшее развитие науки показало, что периодическое повторение свойств элементов через определенные интервалы, особенно отчетливо проявляющиеся во 2 и 3 малых периодах, объясняется повторением электронного строения внешних энергетических уровней, где находятся валентные электроны, за счет которых идет образование химических связей и новых веществ в реакциях. Поэтому в каждом вертикальном столбце-группе оказываются элементы с повторяющимися характерными чертами. Это ярко проявляется в группах, где находятся семейства очень активных щелочных металлов (I группа, главная подгруппа) и неметаллов-галогенов (VII группа, главная подгруппа). Слева направо по периоду число электронов возрастает от 1 до 8, при этом имеет место уменьшение металлических свойств элементов. Таким образом, металлические свойства проявляются тем сильнее, чем меньше электронов на внешнем уровне.
Рис. 3. Малые и большие периоды в таблице Менделеева.
Периодически также повторяются такие свойства атомов, как энергия ионизации, энергия сродства к электрону и электроотрицательность. Эти величины связаны со способностью атома отдать электрон с внешнего уровня (ионизация) или удержать чужой электрон на своем внешнем уровне (сродство к электрону).
Что мы узнали?
Периодический закон и периодическая система химических элементов Д. И. Менделеева, изучаемые в 9 классе, дали толчок для развития всей мировой науки. таким образом, сущность периодичности изменения свойств элементов определяется строением их атомов и особенно повторением электронной конфигурации (строения) внешнего электронного уровня.
-
/10
Вопрос 1 из 10
Вологодское масло: бренд на все времена
Но отдавая дань поддержке промышленности, Менделеев вел на средства Вольного экономического общества и серию сельскохозяйственных опытов.

Обложка прейскуранта молочного хозяйства Н.В. Верещагина. 1897 год
russkiymir.ru
Двух лет хватило Менделееву для того, чтобы пройти современную ему агрономическую науку. Этого же времени было достаточно, чтобы досконально изучить все возможности и проблемы российского сельского хозяйства. Им лично или под его руководством на разных почвах были испробованы десятки минеральных и органических удобрений, реализована программа физико-химического исследования русских грунтов (в химической лаборатории Петербургского университета было тщательно проанализировано около шестисот образцов), даже предпринята попытка создания общества для организации сбыта сельхозпродуктов. «Эти мысли тогда очень занимали меня; думалось призвать к самодеятельности. Пора на то, видно, еще не пришла, если на то внимания никто не обращал…».
Особенно он увлекся масло- и сыроварением под влиянием своего друга Николая Верещагина, создателя и первого поставщика масла, которое уже в советское время получило название «Вологодское», а тогда называлось «Парижское».
Дважды Менделеев выезжал для осмотра сыроварен Верещагина в Тверскую губернию. Именно ради одной из этих поездок Менделеев отказался лично докладывать об открытии периодического закона. Эпохальный доклад по поручению автора сделал его коллега. Сам же Менделеев в те дни готовил масло, сыр и доил по очереди с Николаем Верещагиным корову по кличке Нянька. Происходило это в хозяйстве «первого русского фермера», которое оба единомышленника пропагандировали на собраниях Вольного экономического общества и в печати. Грандиозный замысел Верещагина: развитие скотоводства и подъем сельского хозяйства северных губерний и Сибири, завоевание европейских рынков для отечественных молочных продуктов — Менделеев разделял и одобрял. Ведь и он сам, как и его друг, брался за решение больших государственных вопросов.

Д.И. Менделеев и Н.В. Верещагин в Едимонове в 1869 году. Рисунок В.И. Бландова
m.rusmir.media
Символ 2: значение и применение
Водород является основным строительным блоком всех живых организмов и является необходимым для жизни. Он входит в состав воды (H2O) и многих органических соединений.
Водород также является важным элементом в производстве различных продуктов и технологий. Он используется в процессе получение энергии водородом водородных топливных элементах. Водородная энергия считается чистой и устойчивой, поэтому идет активное исследование и разработка водородных технологий для замены традиционных источников энергии.
Водород также используется в промышленности для производства аммиака, метанола и других химических соединений.
Порядковый номер химического элемента
Заря́довое число́ атомного ядра (синонимы: атомный номер, атомное число, порядковый номер химического элемента) — количество протонов в атомном ядре. Зарядовое число равно заряду ядра в единицах элементарного заряда и одновременно равно порядковому номеру соответствующего ядру химического элемента в таблице Менделеева.
Термин «атомный» или «порядковый» номер обычно используется в атомной физике и химии, тогда как эквивалентный термин «зарядовое число» — в физике ядра. В неионизированном атоме количество электронов в электронных оболочках совпадает с зарядовым числом.
Зарядовое число обычно обозначается буквой Z. Ядра с одинаковым зарядовым числом, но различным массовым числом A (которое равно сумме числа протонов Z и числа нейтронов N) являются различными изотопами одного и того же химического элемента, поскольку именно заряд ядра определяет структуру электронной оболочки атома и, следовательно, его химические свойства.
Смотреть что такое «Порядковый номер химического элемента» в других словарях:
ПОРЯДКОВЫЙ НОМЕР — элемента, то же, что (см. АТОМНЫЙ НОМЕР). Физический энциклопедический словарь. М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983. ПОРЯДКОВЫЙ НОМЕР … Физическая энциклопедия
ПОРЯДКОВЫЙ НОМЕР — химического элемента то же, что атомный номер … Большой Энциклопедический словарь
Порядковый номер элемента — Зарядовое число атомного ядра (синонимы: атомный номер, атомное число, порядковый номер химического элемента) количество протонов в атомном ядре. Зарядовое число равно заряду ядра в единицах элементарного заряда и одновременно равно порядковому… … Википедия
порядковый номер — химического элемента, то же, что атомный номер. * * * ПОРЯДКОВЫЙ НОМЕР ПОРЯДКОВЫЙ НОМЕР химического элемента, то же, что атомный номер (см. АТОМНЫЙ НОМЕР) … Энциклопедический словарь
Атомный номер — порядковый номер химического элемента в периодической системе элементов (См. Периодическая система элементов) Д. И. Менделеева. А. н. равен числу протонов в атомном ядре, которое, в свою очередь, равно числу электронов в электронной… … Большая советская энциклопедия
АТОМНЫЙ НОМЕР — АТОМНЫЙ НОМЕР, порядковый номер химического элемента в периодической системе элементов. Равен числу протонов в атомном ядре, определяет химические и большинство физических свойств атома … Современная энциклопедия
Атомный номер — АТОМНЫЙ НОМЕР, порядковый номер химического элемента в периодической системе элементов. Равен числу протонов в атомном ядре, определяет химические и большинство физических свойств атома. … Иллюстрированный энциклопедический словарь
атомный номер — порядковый номер, Z, номер химического элемента в периодической системе элементов. Равен числу протонов в атомном ядре и определяет химические и большинство физических свойств атома. * * * АТОМНЫЙ НОМЕР АТОМНЫЙ НОМЕР (порядковый номер), Z, номер… … Энциклопедический словарь
АТОМНЫЙ НОМЕР — (порядковый номер) Z, номер химического элемента в периодической системе элементов. Равен числу протонов в атомном ядре и определяет химические и большинство физических свойств атома … Большой Энциклопедический словарь
Химический элемент — Химический элемент совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Каждый химический элемент имеет свои название и символ, которые приводятся в… … Википедия



























