Характеристика и особенности строения
Дисперсные системы представляют собой гетерогенные смеси, в которых одно или несколько веществ распределены в другом. Каждый компонент системы имеет свои свойства. После удаления из системы его статус будет соответствовать исходному.
Определение 2
Вещество, содержание которого в дисперсной системе больше, называется дисперсионной средой.
Второстепенное вещество — дисперсная фаза. В дисперсной системе взаимного взаимодействия между частицами не наблюдается. В то же время существует определенный слой, который их разделяет. Функцию этого слоя выполняет вещество, образующее дисперсионную среду. В связи с этим системы называют гетерогенными или гетерогенными.
Пример 1
Примеры дисперсных систем:
- морская вода;
- почва;
- большая часть еды.
Перечисленные системы могут иметь любое агрегатное состояние. В некоторых случаях допускается одновременное выполнение нескольких этапов. Их можно выделить центрифугированием или разделением.
Определение 3
Дисперсная фаза — вещество, которое равномерно распределено в окружающей дисперсной среде и не взаимодействует ни с ней, ни с другой дисперсной фазой, если она присутствует в дисперсной системе.
Дисперсная фаза может состоять из частиц, капель или пузырьков одинакового или разного размера, которые расположены на некотором расстоянии друг от друга. По кинетическим свойствам (фазовой подвижности) выделяют следующие типы дисперсных систем:
- дисперсная подвижная фаза;
- стационарная фаза, диспергированная с взаимосвязанными и ограниченными движущимися частицами.
Свойства, характеризующие дисперсные системы, зависят от ключевого фактора. В результате их образования образуется четкая межфазная граница.
В природе часто встречаются крупнодисперсные системы. В этом случае фаза и среда различаются при просмотре под микроскопом, а иногда и невооруженным глазом.
Рассмотренные системы характеризуются следующими показателями:
- степень (количество) фаз;
- молекулярная масса;
- размер частицы;
- агрегатное состояние;
- лиофобный / лиофильный.
Дисперсные системы широко распространены в окружающей среде. Они могут быть натурального или натурального происхождения. Есть системы, выведенные в искусственной форме. Явление диспергирования лежит в основе различных лекарственных составов, минеральных и химических удобрений, технологических процессов.
Малодиссоциирующее вещество: влияние на организм
Воздействие малодиссоциирующих веществ на организм может различаться в зависимости от их свойств и конкретного соединения. Некоторые из этих веществ могут обладать токсичностью и вызывать негативные последствия для здоровья, особенно при длительном или интенсивном воздействии.
Один из примеров малодиссоциирующих веществ – свинец. Он находится в природной среде и может попадать в организм человека через воду, пищу или воздух. Свинец имеет токсичное действие на различные системы организма, особенно на нервную систему и почки. Постоянное воздействие свинца может привести к различным заболеваниям, включая отравление, нарушения развития у детей и психические расстройства.
Еще одним примером малодиссоциирующего вещества является алюминий. Он широко используется в промышленности, а также присутствует в многих продуктах, таких как питьевая вода и антациды. Алюминий может оказывать негативное воздействие на нервную систему, костную ткань и иммунную систему. Исследования показали, что длительное воздействие алюминия может быть связано с развитием болезней, включая болезнь Альцгеймера и болезни костей.
Однако не все малодиссоциирующие вещества являются токсичными. Некоторые из них используются в медицине для лечения различных заболеваний. Например, лекарственное средство нитроглицерин является малодиссоциирующим веществом и используется для расширения сосудов и снижения симптомов стенокардии.
Важно отметить, что воздействие малодиссоциирующих веществ на организм зависит от их дозы, способа попадания в организм и индивидуальных характеристик человека. Поэтому необходимо быть внимательным к возможным источникам попадания этих веществ в организм и принимать меры для максимального ограничения их влияния
Регулярные медицинские осмотры и соблюдение рекомендаций врачей также помогут минимизировать риски от воздействия малодиссоциирующих веществ на организм.
Ионный обмен с кислыми солями.
В реакциях ионного обмена могут участвовать кислые соли. Здесь возникает вопрос в правильном написании ионов кислой соли. Впрочем, правила достаточно просты. Если кислая соль образована слабой кислотой (H2S, H2CO3) или кислотой средней силы (H2SO3, H3PO4), то анион кислой соли мы записываем вместе с водородом, исключая его дальнейшую диссоциацию на катион водорода и анион средней соли. То есть распад на ионы запишется так:
NaHS ⇆ Na+ + HS-KHCO3 ⇆ K+ + HCO3-NaHSO3 ⇆ Na+ + HSO3-Na2HPO4 ⇆ 2Na+ + HPO42-NaH2PO4 ⇆ Na+ + H2PO4—
В том случае, если кислая соль образована сильной кислотой, то, строго говоря, такой кислый анион может диссоциировать дальше на катион водорода и анион средней соли. Тем не менее современные требования к ЕГЭ по химии разрешают в ионных уравнениях писать как кислый, так и средний анион. Для гидросульфата натрия два этих варианта выглядят так:
NaHSO4 ⇆ Na+ + HSO4-NaHSO4 ⇆ Na+ + H+ + SO4—
Теперь можно посмотреть, в какие именно реакции ионного обмена вступают кислые соли. Прежде всего это, конечно, нейтрализация. Кислые соли легко реагируют с щелочами, превращаясь в средние соли. Приведем пример.
KHCO3 + KOH → K2CO3 + H2O (молекулярная форма)
Запишем полное ионное уравнение, помня о сказанном выше.
K+ + HCO3— + K+ + OH- → 2K+ + CO32- + H2O (полная ионная форма)
Сократим повторяющиеся ионы и получим краткое ионное уравнение:
K+ + HCO3— + K+ + OH- → 2K+ + CO32- + H2O (полная ионная форма)
HCO3— + OH- → CO32- + H2O (краткая ионная форма)
Если взять дигидрофосфат, то его можно нейтрализовать частично с превращением с гидрофосфат и можно нейтрализовать полностью с превращением в средний фосфат. То, как пойдет реакция, зависит от мольного соотношения щелочи и дигидрофосфата. Если взят избыток щелочи, то нейтрализация будет полной, его недостаток, то нет. Ниже показаны оба случая.
NaH2PO4 + NaOH (недостаток) → Na2HPO4 + H2O (молекулярная форма)
Na+ + H2PO4— + Na+ + OH- → 2Na+ + HPO42- + H2O (полная ионная форма)
H2PO4— + OH- → HPO42- + H2O (краткая ионная форма)
NaH2PO4 + 2NaOH (избыток) → Na3PO4 + 2H2O (молекулярная форма)
Na+ + H2PO4— + 2Na+ + 2OH- → 3Na+ + PO43- + 2H2O (полная ионная форма)
H2PO4— + 2OH- → PO43- + 2H2O (краткая ионная форма)
Есть еще одна ситуация, когда соотношение щелочи и кислоты влияет на то, как протекает реакция. Речь идет о том случае, когда катионы в кислой соли и щелочи разные. Рассмотрим взаимодействие гидрокарбоната калия с гидроксидом бария, взятым в недостатке.
2KHCO3 + Ba(OH)2 (недостаток) → K2CO3 + BaCO3↓ + 2H2O (молекулярная форма)
2K+ + 2HCO3— + Ba2+ + 2OH- → 2K+ + CO32- + BaCO3↓ + 2H2O (полная ионная форма)
2HCO3— + Ba2+ + 2OH- → CO32- + BaCO3↓ + 2H2O (краткая ионная форма)
Здесь происходит обычная нейтрализация гидрокарбоната калия, завершающаяся его превращением в средний карбонат. Катион бария при этом тоже связывается с карбонат-ионом в осадок соли.
Однако если взять избыток гидроксида бария, то образующийся на первом этапе растворимый карбонат калия может с ним прореагировать:
K2CO3 + Ba(OH)2 → 2KOH + BaCO3↓
Тогда суммарно в избытке гидроксида бария реакция запишется так:
KHCO3 + Ba(OH)2 (избыток) → KOH + BaCO3↓ + H2O (молекулярная форма)
K+ + HCO3— + Ba2+ + 2OH- → K+ + OH- + BaCO3↓ + H2O (полное ионное уравнение)
HCO3— + Ba2+ + OH- → BaCO3↓ + H2O (краткое ионное уравнение)
Важно понимать, что продукты реакции в избытке гидроксида могут измениться только в том случае, если с этим гидроксидом может реагировать средняя соль, образующая на первом этапе при его недостатке. Поэтому реакция Ba(HCO3)2 с KOH в избытке щелочи протекает так же, как и при его недостатке
Это связано с тем, что продукт нейтрализации Ва(HCO3)2, образующийся на первом этапе, а именно средняя соль BaCO3 является осадком и далее с КОН не реагирует. А значит, мы в любом случае получим следующие уравнения:
Ba(HCO3)2 + 2KOH → BaCO3↓ + K2CO3 + 2H2O (молекулярная форма)
Ba2+ + 2HCO3— + 2K+ + 2OH- → BaCO3↓ + 2K+ + CO32- + 2H2O (полное ионное уравнение)
Ba2+ + 2HCO3— + 2OH- → BaCO3↓ + CO32- + 2H2O (краткое ионное уравнение)
Также кислые соли, образованные слабыми кислотами, могут вступать в реакции с сильными кислотами. В этом случае слабая кислота вытесняется из своей кислой соли в индивидуальном виде. Ниже приведен пример:
И в заключении этого раздела приведем пример с участием кислой соли сильной кислоты. Это взаимодействие ацетата бария и гидросульфата калия.
Ba(CH3COO)2 + KHSO4 → BaSO4↓ + CH3COOK + CH3COOH (молекулярная форма)
Ba2+ + 2CH3COO- + K+ + HSO4— → BaSO4↓ + CH3COO- + K+ + CH3COOH (полная ионная форма)
Ba2+ + CH3COO- + HSO4— → BaSO4↓ + CH3COOH (краткая ионная форма)
Напомним, что в ионных уравнениях допустимо писать вместо иона HSO4— сумму ионов H+ и SO42-.
Коллоиды и кристаллоиды. Истинные и коллоидные растворы
Особое место в природе занимают коллоидные системы. Еще в середине XIX века шотландский ученый Томас Грэм обнаружил, что некоторые вещества, обычно не растворимые в воде, при определенных условиях могут образовывать с ней однородные смеси, отличающиеся от обычных растворов. Так, обычные растворы проходят через фильтр из растительного пергамента полностью и в дальнейшем способны кристаллизоваться, а смеси из нерастворимых веществ и воды не проходят через поры такого фильтра и не способны кристаллизоваться.
Растворы, проходящие через фильтр и способные кристаллизоваться, он назвал кристаллоидами, их принято называть истинными растворами. Смеси, не проходящие через фильтр – коллоидами, по названию клея (по греч. – «колла») или коллоидными растворами (золями). Данная классификация является простой, но устаревшей.
В истинных растворах присутствуют отдельные ионы и молекулы, тогда как в коллоидных растворах присутствуют более крупные частицы.
Классификация коллоидных систем
Коллоидные системы могут быть не только жидкими (молоко, горячий раствор желатина), но и твёрдыми (яшма и многие другие окрашенные минералы), и газообразными (дым, туман).
Если дисперсионной средой выступает вода, то коллоид называется гидрозолем, если спирт – алкозоли, если бензол – бензозоли и т. д.
Если дисперсионной средой выступает газ, то коллоид называется аэрозолем.
Электролиты и неэлектролиты
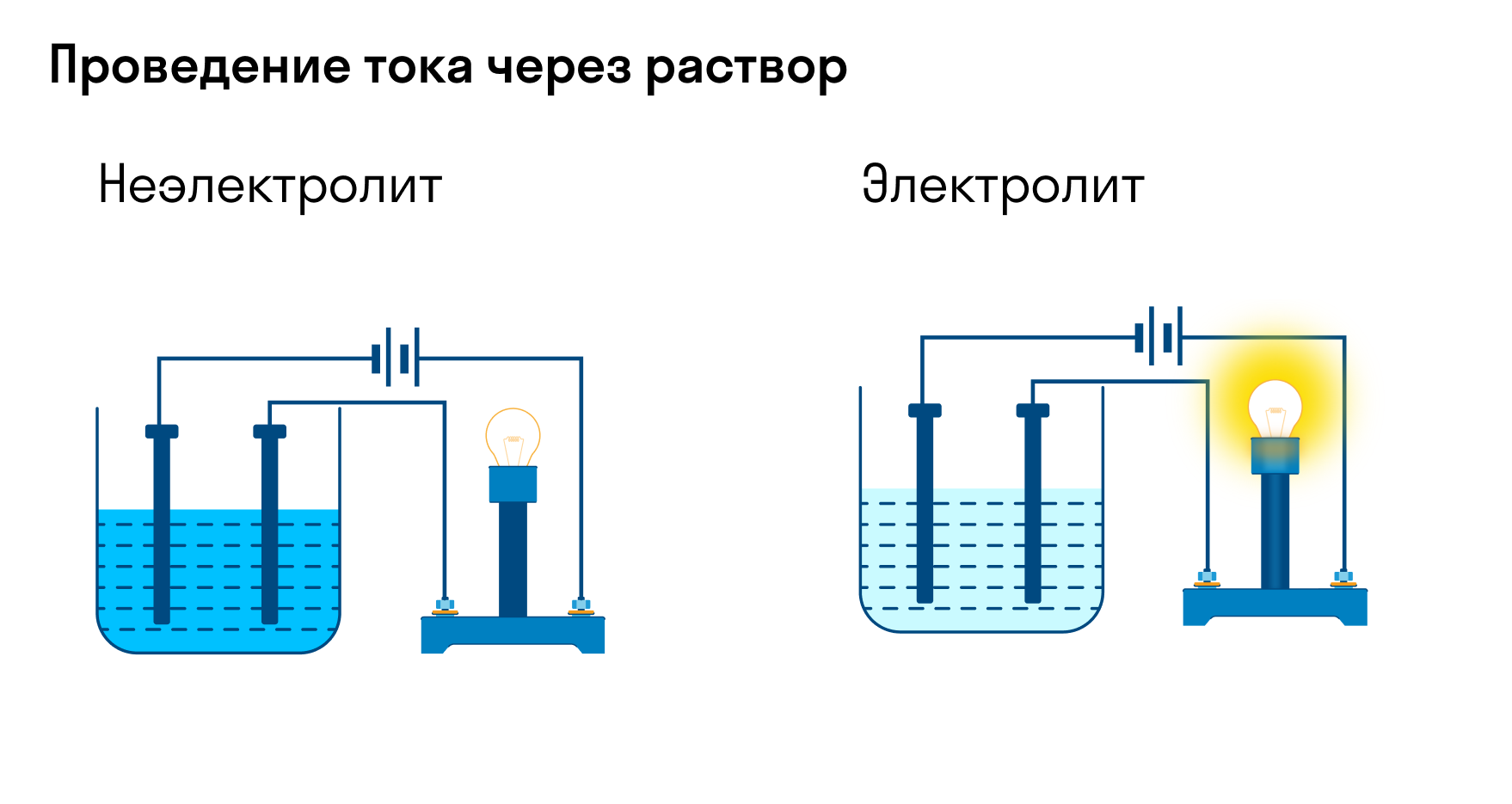
Хотя электролитическая диссоциация происходит независимо от действия электротока, между этими явлениями есть связь. Чем выше способность вещества распадаться на ионы при взаимодействии с растворителем, тем лучше оно проводит электроток. По такому критерию известный физико-химик М. Фарадей выделил электролиты и неэлектролиты.
Электролиты — это вещества, которые после диссоциации на ионы в растворах и расплавах проводят электроток. Обычно в их молекулах ионные или полярные ковалентные связи.
Неэлектролиты — это вещества, которые не распадаются на ионы в растворах и расплавах, а значит, не обладают проводимостью в растворенном виде. Для них характерны ковалентные неполярные или слабополярные связи.
Степень диссоциации
В зависимости от того, сколько молекул диссоциировало на ионы, вещество может быть сильным или слабым электролитом. Этот показатель называется степенью диссоциации, его измеряют от 0 до 1 либо в процентах.
Степень диссоциации — это отношение количества распавшихся на ионы молей вещества к исходному количеству молей.
или .
Если в растворе на ионы распадаются все 100% электролита, .
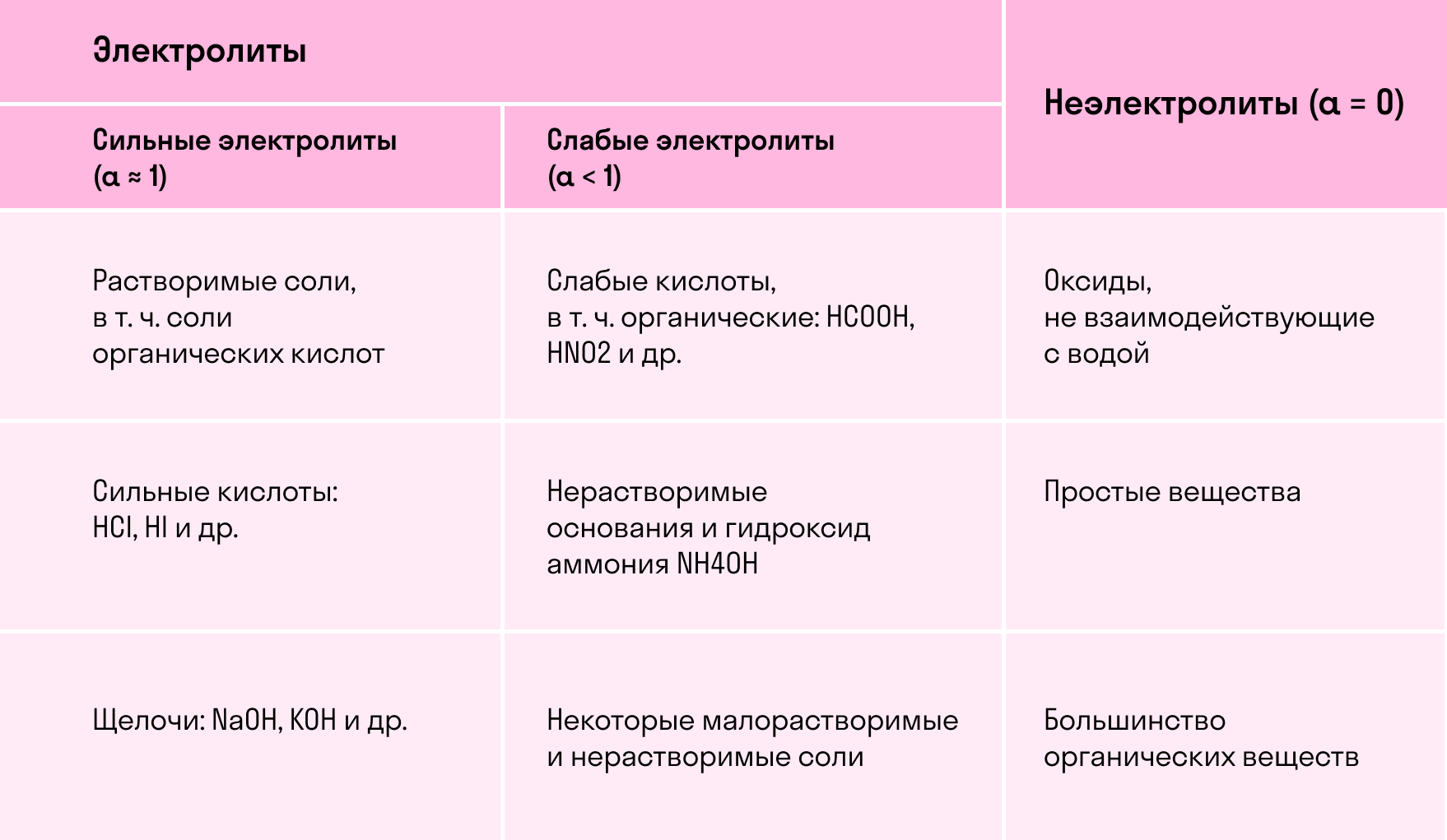
По силе электролиты делятся на следующие группы:
-
слабые — ;
-
средние — ;
-
сильные — .
Важно!
Молекулы сильных электролитов необратимо распадаются на ионы, поэтому в уравнениях нужно ставить знак =. Реакции со слабыми электролитами обратимы, поэтому ставится знак ⇄
Химические свойства малодиссоциирующих веществ
Малодиссоциирующее вещество – это вещество, которое слабо диссоциирует в воде или в других растворителях. Слабое диссоциирование означает, что только небольшое количество молекул вещества распадается на ионы, что приводит к низкой электропроводности раствора.
Одним из примеров малодиссоциирующих веществ является уксусная кислота, которая диссоциирует только в небольшом количестве, образуя лишь небольшое количество ионов водорода и ацетат-ионов. Это свойство делает уксусную кислоту полезной во многих химических и биологических процессах.
Свойства малодиссоциирующих веществ связаны с их молекулярной структурой и силой взаимодействия между молекулами. Некоторые вещества ионосвязанные, то есть их молекулы связаны между собой через ионы, и они диссоциируют в воде или других растворителях с высокой электропроводностью. В других случаях молекулы малодиссоциирующих веществ связаны друг с другом через ковалентные связи, что приводит к слабой диссоциации.
Химические свойства малодиссоциирующих веществ важны для понимания и изучения многих химических реакций. Эти вещества могут использоваться в различных химических процессах, где они выполняют роль катализаторов, растворителей или регуляторов pH. Понимание этих свойств также помогает проектировать новые лекарства и материалы, которые смогут эффективно взаимодействовать с биологическими системами или использоваться в электронике и других технологиях.
Классификация по агрегатному состоянию
Классификация дисперсных систем проводится по агрегатным состояниям вещества. Бывают трех типов: жидкие, твердые и газообразные. Таким образом, разделение происходит на 9 основных категорий, примеры и описания которых можно найти в таблице ниже.
| Визуализация | Среда | Фаза | Пример |
| Газ x 2 | Газ | Газ | Отсутствует |
| Жидкость + газ | Газ | Жидкость | Туман, облако |
| Твердый корпус (далее ТТ) + газ | Газ | TT | Дым, пыль |
| Газ + жидкость | Жидкость | Газ | Любая пена |
| Жидкость x 2 | Жидкость | Жидкость | Молоко |
| ТТ + жидкость | Жидкость | TT | Известь, ил |
| Газ + ТТ | TT | Газ | Пемза |
| Жидкость + твердое тело | TT | Жидкость | Грунтовка |
| TT + TT | TT | TT | Любой композитный материал, например бетон или цемент |
У каждого типа классификации, в свою очередь, есть свое название. Например, газообразные соединения в основном называют аэрозолями, за редким исключением. Жидкие вещества — эмульсии или газовые суспензии. Взаимодействия, когда среда является твердым телом, определяются как сплавы, капиллярные системы или пористые вещества.
Теория электролитической диссоциации
( С.
Аррениус, 1887г. )
1.При
растворении
в воде (или
расплавлении)
электролиты
распадаются
на
положительно
и отрицательно
заряженные
ионы
(подвергаются
электролитической
диссоциации).
2.Под
действием
электрического
тока катионы
(+) двигаются к
катоду (-), а
анионы (-) – к
аноду (+).
3.Электролитическая
диссоциация —
процесс обратимый
(обратная
реакция
называется моляризацией).
4.Степень
электролитической
диссоциации (a)
зависит от
природы
электролита
и растворителя,
температуры
и
концентрации.
Она показывает
отношение
числа
молекул,
распавшихся
на ионы (n) к
общему числу
молекул,
введенных в
раствор (N).
a = nN 0<a<1
Растворимость газов
Все природные воды представляют газовые растворы
При изучении природных вод важное значение имеет следующее равновесие: природные воды — природные газы.. Обычно газ растворен в воде, но при избытке часть его может находиться в свободном (спонтанном) состоянии, т
е. в виде мельчайших пузырьков. Следовательно, всегда существует подвижное равновесие: растворенные в воде газы — свободные газы. Поглощение газа водой и выделение газа водой — важнейший физико-химический и физический процесс, сопровождаемый изменением ионно-солевого состава воды.
Обычно газ растворен в воде, но при избытке часть его может находиться в свободном (спонтанном) состоянии, т. е. в виде мельчайших пузырьков. Следовательно, всегда существует подвижное равновесие: растворенные в воде газы — свободные газы. Поглощение газа водой и выделение газа водой — важнейший физико-химический и физический процесс, сопровождаемый изменением ионно-солевого состава воды.
Газы находятся в водах в виде молекулярных растворов. Природные газы представляют собой, как правило, газовые смеси, в которых можно различать главные и второстепенные компоненты. Растворимость газов в воде зависит от природы газа, температуры, давления и минерализации воды. Большой растворимостью в воде обладают сероводород и углекислый газ.
Зависимость растворимости газов от давления определяется законом Генри: растворимость газов в данном объеме жидкости (при постоянной температуре) прямо пропорциональна давлению газа
![]()
Растворимость смеси газов определяется законом Генри — Дальтона: растворимость каждой составной части смеси газов в жидкости пропорциональна парциальному (частичному) давлению данной составной части над раствором.
Ввиду различной растворимости составляющих газовую смесь компонентов химический состав свободного и находящегося с ним в равновесии растворенного газа неодинаков. Возьмем для примера атмосферный воздух. В нем содержится азота 78%, кислорода 21 % и отношение кислорода к азоту приблизительно составляет 1:4. При парциальном давлении кислорода 0,21, а азота 0,78 растворимость газов при t=0°C будет равна (в °/оо по объему):
22
Газы H2S и H2, парциальное давление которых в атмосферною воздухе близко к нулю, в нормальных условиях не могут накапли ваться в воде у поверхности водоемов.
Больше всего растворяется газов в пресных холодных водах, тогда как с увеличением минерализации растворимость газа уменьшается. Содержание газов в природных водах определяется также интенсивностью химических, биологических и гидрологических (перемешивание, вертикальная зимняя циркуляция и др.) процессов. Поэтому содержание многих газов (O2, CO2, N2) часто выражают в процентах от их насыщающего количества. За насыщение принимают то количество газа, которое может растворяться в воде при данной температуре и минерализации (при сухом атмосферном воздухе и нормальном давлении).
Сильные и слабые электролиты.
Распад соединения на ионы в растворе называется электролитической диссоциацией. Если такое соединение хорошо распадается на ионы, оно называется сильным электролитом, если плохо, то слабым электролитом. Перечислим классы веществ, которые являются сильными электролитами.
А) Растворимые гидроксиды металлов.
Например, это NaOH, KOH, Ba(OH)2 и другие. В этом случае распад на ионы описывается, например, для гидроксида натрия так:
NaOH ⇆ Na+ + OH- (процесс протекает хорошо, NaOH сильный электролит)
Соответственно если гидроксид металла нерастворим, то распад на ионы протекает плохо, и мы имеем дело со слабым электролитом. Возьмем для примера нерастворимый в воде гидроксид алюминия:
Al(OH)3 ⇆ Al3+ + 3OH- (процесс протекает плохо, потому что Al(OH)3 нерастворим в воде; Al(OH)3 слабый электролит)
Тем не менее есть реакции ионного обмена, в которые вступают нерастворимые гидроксиды.
Б) Сильные кислоты в воде.
Если взять сильную кислоту HCl или H2SO4 в индивидуальном виде, то в их молекулах не будет ионной связи и, соответственно, ионов. Для образования ионной связи разница электроотрицательностей между H и Сl, а также между H и O слишком мала. Однако если эти кислоты поместить в воду, то под действием воды связь H-Cl в HCl и связи H-O в H2SO4 становятся ионными, в результате чего кислоты распадаются на ионы:
HCl ⇆ H+ + Cl- H2SO4 ⇆ 2H+ + SO42-
По определению сильная кислота – это такая, которая хорошо распадается на ионы. Поэтому любая сильная кислота – это автоматически сильный электролит, который подходит для участия в реакциях ионного обмена.
Однако если кислота слабая или нерастворимая в воде, то распад на ионы протекает плохо и ионов в растворе мало. Например:
H2S ⇆ 2H+ + S2- (процесс протекает плохо, H2S слабый электролит)
H2SiO3 ⇆ 2H+ + SiO32- (процесс протекает плохо, к тому же H2SiO3 нерастворима в воде, поэтому эта кислота слабый электролит).
CH3COOH ⇆ H+ + CH3COO- (процесс протекает плохо, CH3COOH слабый электролит)
Тем не менее слабые кислоты тоже могут участвовать в реакциях ионного обмена, просто в полном и кратком ионных уравнениях (о которых мы поговорим ниже) их нельзя будет записывать в виде ионов.В) Растворимые соли.
Все соли имеют ионное строение, поэтому, если они растворимы, они распадаются на ионы. Например:
NaCl ⇆ Na+ + Cl-K3PO4 ⇆ 3K+ + PO43-
Это сильные электролиты. Если соль в воде нерастворима, то распад на ионы не протекает и перед нами слабый электролит.
BaSO4 ⇆ Ba2+ + SO42- (процесс не протекает, потому что BaSO4 нерастворим в воде).
И снова следует сказать, что требование растворимости для соли необязательно, потому что в реакции ионного обмена могут вступать и нерастворимые соли.
Итак, мы видим, что по каждому пункту у нас есть исключения. Нерастворимые гидроксиды и соли, а также слабые кислоты, будучи слабыми электролитами, вполне могут вступать в реакции ионного обмена. Получается, что свойство сильного электролита не является необходимым требованием к веществу, вступающему в реакцию ионного обмена. Может вообще создаться впечатление, что в такую реакцию вступает любая пара ионных веществ вне зависимости от того, сильные они или слабые электролиты. Тем не менее это не так. Для того, чтобы ионный обмен произошел, должны выполняться определенные условия. А информация о сильных и слабых электролитах нам потребуется, когда мы будем составлять полные и краткие ионные уравнения.
Растворение осадков
Правило
произведения
растворимости
важно для
переведения
труднорастворимых
осадков в
раствор.
Предположим,
что надо растворить
осадок BaСO3.
Раствор,
соприкасающийся
с этим
осадком, насыщен
относительно
BaСO3.
Это означает,
что Ba2+] • = ПРBaCO3. Если
добавить в
раствор
кислоту, то
ионы H+свяжут
имеющиеся в
растворе
ионы CO32- в
молекулы
непрочной
угольной
кислоты:
Если
добавить в
раствор
кислоту, то
ионы H+свяжут
имеющиеся в
растворе
ионы CO32- в
молекулы
непрочной
угольной
кислоты:
2H++ CO32-H2CO3H2O + CO2
Вследствие
этого резко
снизится
концентрация
иона CO32-,
ионное
произведение
станет
меньше
величины ПРBaCO3.
Раствор
окажется
ненасыщенным
относительно
BaСO3и часть
осадка BaСO3перейдет
в раствор.
При
добавлении
достаточного
количества
кислоты
можно весь
осадок
перевести в
раствор.
Следовательно,
растворение
осадка
начинается
тогда, когда
по какой-либо
причине
ионное произведение
малорастворимого
электролита
становится
меньше
величины ПР.
Для того,
чтобы
растворить
осадок, в
раствор
вводят такой
электролит,
ионы
которого могут
образовывать
малодиссоциированное
соединение с
одним из
ионов
труднорастворимого
электролита.
Этим
объясняется
растворение
труднорастворимых
гидроксидов
в кислотах
Fe(OH)3+ 3HCl FeCl3+ 3H2O
Ионы OH-
связываются
в
малодиссоциированные
молекулы H2O.
Таблица.Произведение
растворимости
(ПР) и растворимость
при 25°С некоторых
малорастворимых
веществ
|
Формула |
Растворимость |
ПР |
|
AgBr |
7,94 • |
6,3 • 10 -13 |
|
AgCl |
1,25 • 10 -5 |
1,56 • 10 -10 |
|
AgI |
1,23 • 10 -8 |
1,5 • 10 -16 |
|
Ag2CrO4 |
1,0 • 10 -4 |
4,05 • 10 -12 |
|
BaSO4 |
7,94 • 10 -7 |
6,3 • 10 -13 |
|
CaCO3 |
6,9 • 10 -5 |
4,8 • 10 -9 |
|
PbCl2 |
1,02 • 10 -2 |
1,7 • 10 -5 |
|
PbSO4 |
1,5 • 10 -4 |
2,2 • 10 -8 |
РЕАКЦИИ ОБМЕНА В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
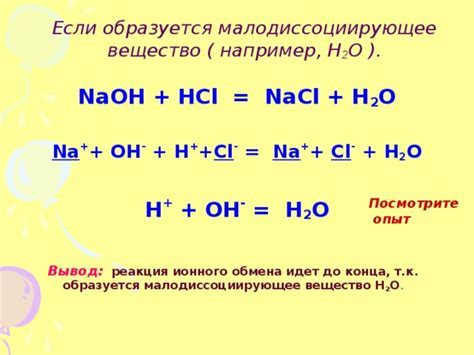
Необходимым условием протекания обменных реакций в растворах электролитов является удаление из раствора тех или иных ионов вследствие образования малодиссоциирующих (слабые электролиты и комплексные ионы) или малорастворимых веществ (осадки и газы).
Реакции обмена в растворах электролитов записывают в виде трех уравнений: молекулярного, полного ионно-молекулярного и сокращенного ионно-молекулярного. Для составления этих уравнений необходимо знать характер электролитической диссоциации участников реакции.
Малодиссоциирующие и малорастворимые вещества в ионно-молекулярных уравнениях записываются в молекулярном виде. Реакции, в которых слабые электролиты или малорастворимые вещества входят в состав только продуктов реакции, протекают, как правило, необратимо, т.е. до конца.
Примеры реакций, протекающих практически необратимо:
1.с образованием малодиссоциирующих соединений:
а) HCl + NaOH = NaCl + H2O — молекулярное уравнение,
H + + Cl — + Na + + OH — = Na + + Cl — + H2O — полное ионно-молекулярное уравнение,
H + + OH — = H2O — сокращенное ионно-молекулярное уравнение,
б) NaF + HCl = NaCl + HF,
F — + H + = HF — сокращенное ионно-молекулярное уравнение,
в) NH4Cl + NaOH = NH3· H2O + NaCl,
NH4 + + OH — = NH3·H2O — сокращенное ионно-молекулярное уравнение,
Таким образом, сильные кислоты (основания) вытесняют слабые кислоты (основания) из растворов их солей.
2.с образованием малорастворимых веществ:
а) NaCl + AgNO3 = NaNO3 + AgCl
Cl — + Ag + = AgCl — сокращенное ионно-молекулярное уравнение.
Реакции, в которых слабые электролиты или малорастворимые вещества входят в состав как продуктов, так и исходных веществ, протекают, как правило, не до конца, т.е. являются обратимыми. Равновесие обратимого процесса в этих случаях смещено в сторону образования наименее диссоциированных или наименее растворимых частиц. Примеры обратимых реакций, равновесие которых смещено вправо:
1.HF + NaOH NaF + H2O,
HF + OH — F — + H2O — сокращенное ионно-молекулярное уравнение.
Вода более слабый электролит, чем HF: Kд(H2O) = 1,8·10 -16 ; Kд(HF) = 6,6·10 -4 , поэтому равновесие обратимого процесса смещено в сторону образования H2O.
NH3·H2O + H + NH4 + + H2O — сокращенное ионно-молекулярное уравнение
HF + NH3·H2O NH4 + + F — + H2O — сокращенное ионно-молекулярное уравнение
Реакции нейтрализации слабых кислот (оснований) сильными основаниями (кислотами) или слабых кислот слабыми основаниями не доходят до конца (т.е. точка эквивалентности находится, соответственно, в основной или кислой области значений рН).
4.AgCl + NaI NaCl + AgI ,
AgCl + I — Cl — + Ag — сокращенное ионно-молекулярное уравнение
ПР(AgCl) = 1,78· 10 -10 ПР(AgI) = 8,3· 10 -17
Источник




























