Проводимость металлов: электронный газ
Кристаллическая решетка металла создает внутренние силы, способствующие тому, чтобы электроны с внешних оболочек покидали «свое» ядро. Для их перехода в свободное состояние, переход в зону проводимости, не требуется дополнительных усилий.
Если к металлическому предмету приложить электрическое поле – потечет ток. Электрический ток – это суммарный электрический заряд, проходящий через сечение проводящего тела за секунду.
Электроны приходят в движение по всей длине проводника, измеренные значения тока одинаковы в любом сечении.
Отметим, что ток мгновенно возникает во всем проводнике благодаря распространению электрического поля, но свободные носители заряда, электроны, продвигаются весьма медленно.
При малых напряжениях они еле бредут, наталкиваясь на ядра атомов, их тепловое движение гораздо интенсивнее, чем упорядоченное перемещение к положительному электроду.
Если металл нагревать, ток уменьшится. Это оттого что тепловое движение самих электронов и кристаллической решетки замедляет упорядоченное движение электронов, иными словами, при повышении температуры электрическое сопротивление металл увеличивается, а его проводимость уменьшается.
Электрический ток повышает температуру металла, с этим связан первоначальный скачок тока в проводнике и последующее его снижение. Холодный металл имеет небольшое сопротивление и пропускает значительный ток; но этот ток нагревает металл, сопротивление растет, ток уменьшается.
Заполнение орбиталей подуровня. Правило Хунда
Порядок заполнения орбиталей подуровня определяется правилом Хунда:
В пределах подуровня электроны заполняют максимальное число орбиталей
Например. электронная схема атома углерода $(С)$ — $1s^22s^22р^2$. В соответствии с правилом Хунда, второй $р$-электрон займет пустую орбиталь, а не ту, на которой уже имеется электрон. Т.е. при построении электронной схемы он должен быть вписан в следующую пустую ячейку, а не в ту, в которой уже вписан предыдущий электрон:
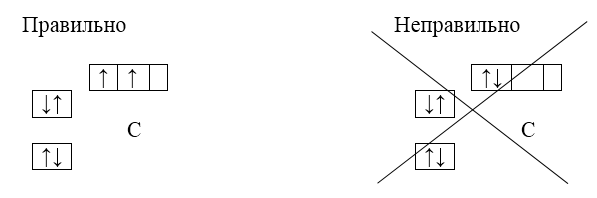 Рисунок 5.
Рисунок 5.
В атоме азота $(N)$ все $2p$-орбитали оказываются занятыми:
Рисунок 6.
Восьмой электрон кислорода $(О)$ помещается на уже занятую одним электроном $р$-орбиталь. Образуя пару электронов с противоположными спинами:
У фтора $(F)$ и неона $(Ne)$ расположение электронов на орбиталях атомов следующее:
 Рисунок 7.
Рисунок 7.
Если атом имеет несколько одиночных электронов, то спиновые моменты последних суммируются. Поэтому спины атомов $В$, $С$, $N$, $O$, $F$, $Ne$ равны соответственно $\frac{1}{2}$, $1$, $1 \frac{1}{2}$, $1$, $\frac{1}{2}$, $0$. С учетом этого правило Хунда можно сформулировать так:
Суммарный спин электронов в данном подуровне должен быть максимальным
Отрицательный заряд
Так или иначе, атомы внутри молекул и веществ соединены между собой электронами — крохотными субатомными частицами, образующими облако отрицательного заряда вокруг положительно заряженного ядра. Электроны упорядочены внутри атома в соответствии со своим уровнем энергии и образуют электронные оболочки вокруг ядра, а поскольку у атомов каждого элемента разное количество электронов, на внешней оболочке атомов оказывается разное число электронов. Электронное облако атома натрия выглядит не так, как у хлора, и у этой разницы есть свои интересные следствия. Скажем больше: это вообще причина их соединения. Натрий легко отдает единственный электрон с внешней оболочки. Потеря одной отрицательно заряженной частицы превращает атом натрия в положительно заряженный ион (Na+). А вот атом хлора легко присоединяет один электрон и так заполняет свою внешнюю электронную оболочку, превращаясь в отрицательно заряженный ион (С1-). Противоположности притягиваются — и извольте: получается химическая связь. И немножко соли — хлорида натрия (NaCl).
Вдумавшись в Периодическую таблицу, понимаешь, до чего легко электроны добыть и потерять и что именно распределение отрицательного заряда определяет, как атомы вещества крепятся друг к дружке. От того, как электрон добыт, отдан или перешел в общее пользование, зависит тип связи между атомами и типы веществ, которые из этих атомов состоят.
Процесс обобществления электронов
Обобществление электронов — это процесс, при котором электроны в материале начинают взаимодействовать друг с другом и образуют коллективное поведение. Этот процесс имеет свои особенности и играет важную роль в различных физических явлениях.
Основными факторами, влияющими на процесс обобществления электронов, являются:
- Температура: при низких температурах электроны имеют меньшую энергию и сильно взаимодействуют друг с другом. Это приводит к образованию различных коллективных состояний, таких как сверхпроводимость или ферромагнетизм.
- Плотность электронов: при высокой плотности электронов в материале, взаимодействие между ними становится более существенным. Такие системы электронов могут образовывать электронные газы или плазмы.
- Тип материала: тип материала (металл, полупроводник, изолятор) также оказывает влияние на процесс обобществления электронов. В металлах электроны свободно перемещаются и могут образовывать электронные облака, а в полупроводниках и изоляторах электроны более ограничены в своем движении.
Процесс обобществления электронов может приводить к различным физическим явлениям и свойствам материалов. Например, сверхпроводимость — это состояние материала, при котором электроны образуют пары и движутся без сопротивления. При достижении определенной температуры, называемой критической температурой, материал становится сверхпроводником.
Кроме того, обобществление электронов может приводить к магнитному поведению материала. При достижении определенной температуры, называемой температурой Кюри, материал может стать ферромагнетиком, а в некоторых случаях — антиферромагнетиком или ферримагнетиком, в зависимости от типа взаимодействия электронов.
Примеры физических явлений, связанных с обобществлением электронов
Явление
Описание
Примеры материалов
Сверхпроводимость
Отсутствие электрического сопротивления в материале
Ртуть, титан, ниобий
Ферромагнетизм
Появление постоянной намагниченности
Железо, никель, кобальт
Антиферромагнетизм
Появление антипараллельной ориентации магнитных моментов
Хром, марганец
Роль обобществления в структуре металлов
Механизм металлической связи основан на обобществлении внешних электронов в металлах. Именно благодаря этому обобществлению, металлы обладают такими характерными свойствами, как высокая теплопроводность и электропроводность.
Когда металлы образуют трехмерную решетку, их атомы располагаются близко друг к другу и создают сильные электростатические взаимодействия. В результате электроны с внешней оболочки атомов металла могут свободно двигаться по всему объему материала.
Электроны, находящиеся в таком обобществленном состоянии, называются свободными электронами. Они создают своеобразное электронное облако, окружающее положительно заряженные ядра металлических атомов.
Именно эта сеть свободных электронов обеспечивает металлам их способность проводить электрический ток. При подведении электрического поля, свободные электроны начинают двигаться по всей структуре металла, создавая ток. Также эти электроны отвечают за механизм теплопроводности металлов.
Электрический заряд
article>ÐлекÑÑиÑеÑкий заÑÑд â ÑÑо ÑизиÑеÑÐºÐ°Ñ Ð²ÐµÐ»Ð¸Ñина, коÑоÑÐ°Ñ Ð¾Ð¿ÑеделÑÐµÑ ÑпоÑобноÑÑÑ Ñел ÑоздаваÑÑ ÑлекÑÑомагниÑное поле и пÑинимаÑÑ ÑÑаÑÑие в ÑлекÑÑомагниÑном взаимодейÑÑвии.
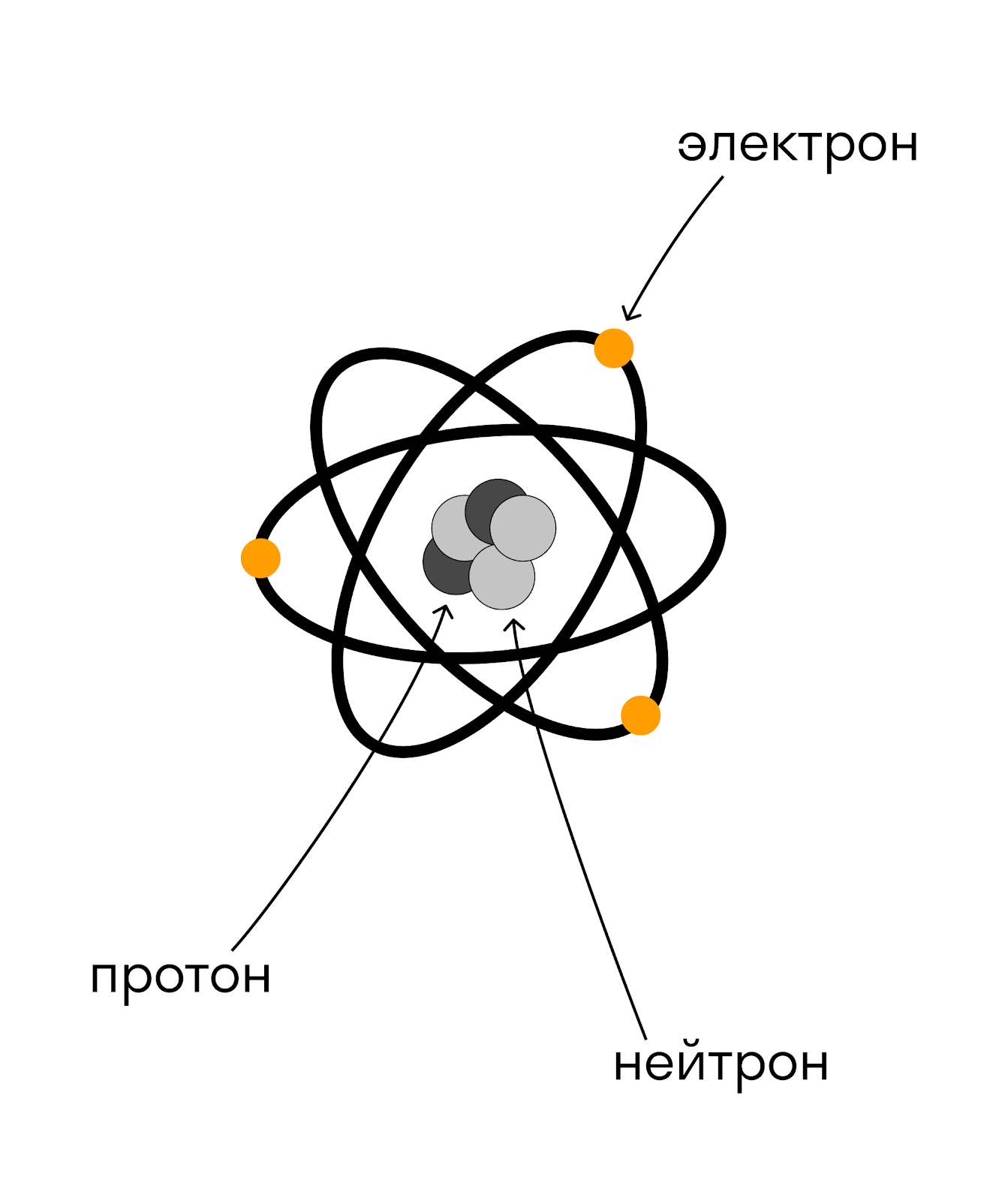
ÐÑ ÑоÑÑоим из клеÑок, клеÑки ÑоÑÑоÑÑ Ð¸Ð· молекÑл, молекÑÐ»Ñ Ð² ÑÐ²Ð¾Ñ Ð¾ÑеÑÐµÐ´Ñ ÑоÑÑоÑÑ Ð¸Ð· аÑомов, а аÑÐ¾Ð¼Ñ â из ÑдÑа и ÑлекÑÑонов. ЯдÑо ÑоÑÑÐ¾Ð¸Ñ Ð¸Ð· пÑоÑонов и нейÑÑонов.
ÐÑоÑон â ÑÑо ÑаÑÑиÑа, коÑоÑÐ°Ñ Ð·Ð°ÑÑжена положиÑелÑно, нейÑÑон â нейÑÑалÑно, а ÑлекÑÑон â оÑÑиÑаÑелÑно. ÐлекÑÑÐ¾Ð½Ñ Ð²ÑаÑаÑÑÑÑ Ð¿Ð¾ оÑбиÑам, коÑоÑÑе во много Ñаз болÑÑе, Ñем ÑÐ°Ð·Ð¼ÐµÑ ÑлекÑÑона.
Ð Ð°Ð·Ð¼ÐµÑ ÑлекÑÑона Ñ ÑазмеÑом оÑбиÑÑ Ð¼Ð¾Ð¶Ð½Ð¾ ÑÑавниÑÑ Ñак: пÑедÑÑавÑÑе ÑÑÑболÑнÑй мÑÑ Ð¸ ÑÑÑболÑное поле. Ðо ÑколÑко Ñаз поле болÑÑе мÑÑа, во ÑÑолÑко же Ñаз оÑбиÑа болÑÑе, Ñем ÑлекÑÑон.
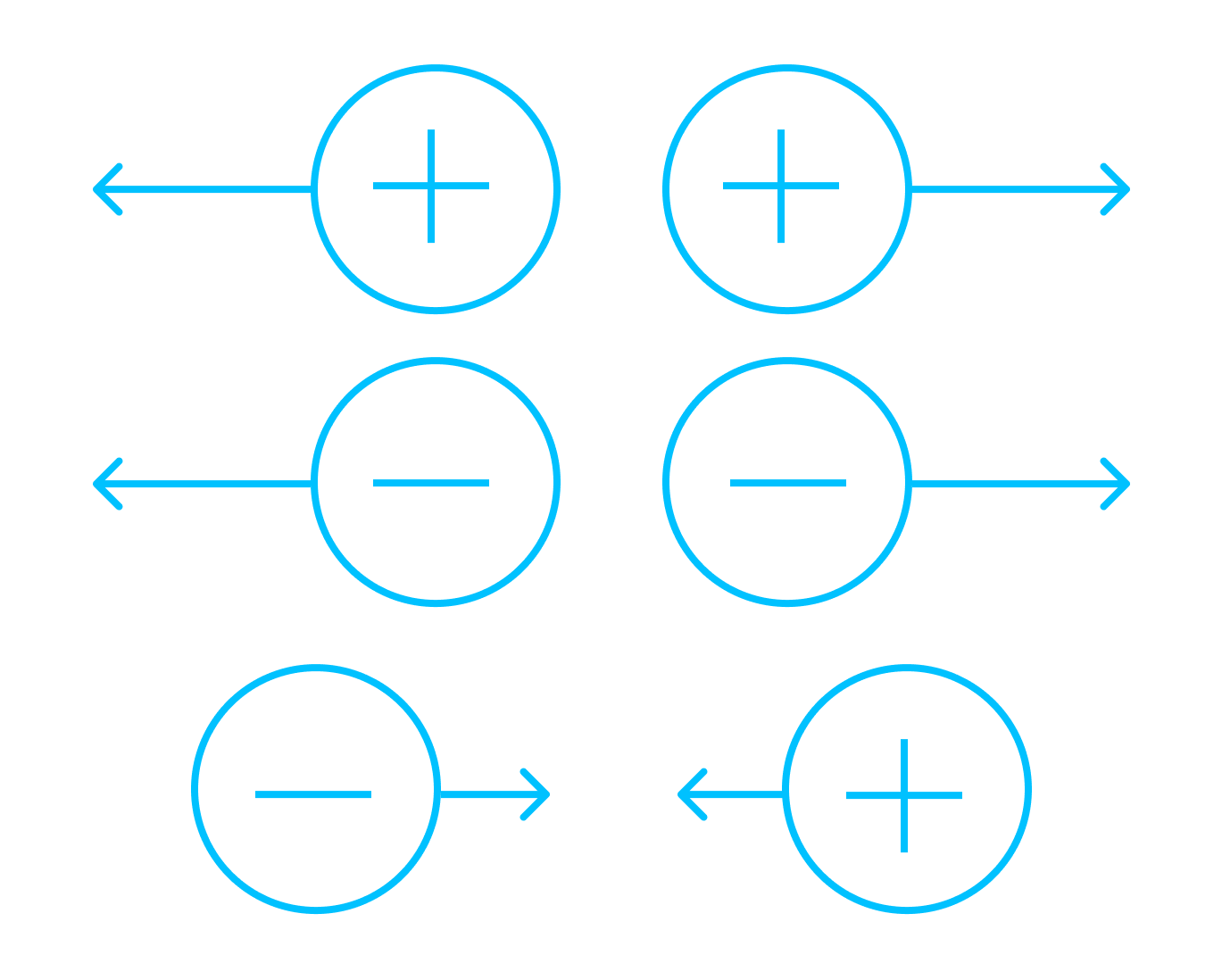
Ðак Ð¼Ñ Ñже вÑÑÑнили, ÑлекÑÑиÑеÑкие заÑÑÐ´Ñ Ð±ÑваÑÑ Ð¿Ð¾Ð»Ð¾Ð¶Ð¸ÑелÑнÑми и оÑÑиÑаÑелÑнÑми. ÐдноименнÑе заÑÑÐ´Ñ Ð¾ÑÑалкиваÑÑÑÑ, ÑазноименнÑе пÑиÑÑгиваÑÑÑÑ:
Ð Ð²Ð¾Ñ Ð¸Ð·Ð¼ÐµÑÑÑÑ ÐлекÑÑиÑеÑкий заÑÑд Ð¼Ñ Ð±Ñдем в ÐÑÐ»Ð¾Ð½Ð°Ñ . ÐеÑ, не ÑеÑ, ÑÑо болÑаÑÑÑÑ Ð½Ð° ÑепоÑке. ШаÑÐ»Ñ ÐÑлон â ÑÑо Ñизик, коÑоÑÑй изÑÑал ÑлекÑÑомагниÑнÑе ÑвлениÑ.


Что такое обобществление электронов
Обобществление электронов — это явление, которое возникает в проводниках при протекании электрического тока. Вещества, которые способны проводить электричество, содержат в своей структуре свободные электроны. Когда на проводник подается электрическое напряжение, эти свободные электроны начинают двигаться в одном направлении и создают электрический ток.
Обобществление электронов происходит в результате соударений свободных электронов с атомами вещества и другими электронами. В процессе соударений электроны передают свою энергию друг другу, что позволяет им двигаться синхронно и образовывать поток, смещаясь в определенном направлении.
В результате обобществления электронов возникают основные свойства электрического тока, такие как проводимость, сопротивление, напряжение и др. Кроме того, обобществление электронов позволяет электрическому току протекать через всю систему проводников, связывая их вместе и обеспечивая передачу электроэнергии.
Квантовые числа
У каждого взрослого человека есть жизненно важные документы: паспорт, СНИЛС, медицинский полис и другие. У электрона тоже есть свои важнейшие «документы» — набор квантовых чисел:
- главное квантовое число (n);
- орбитальное квантовое число (l);
- магнитное квантовое число (ml);
- спиновое квантовое число (ms).
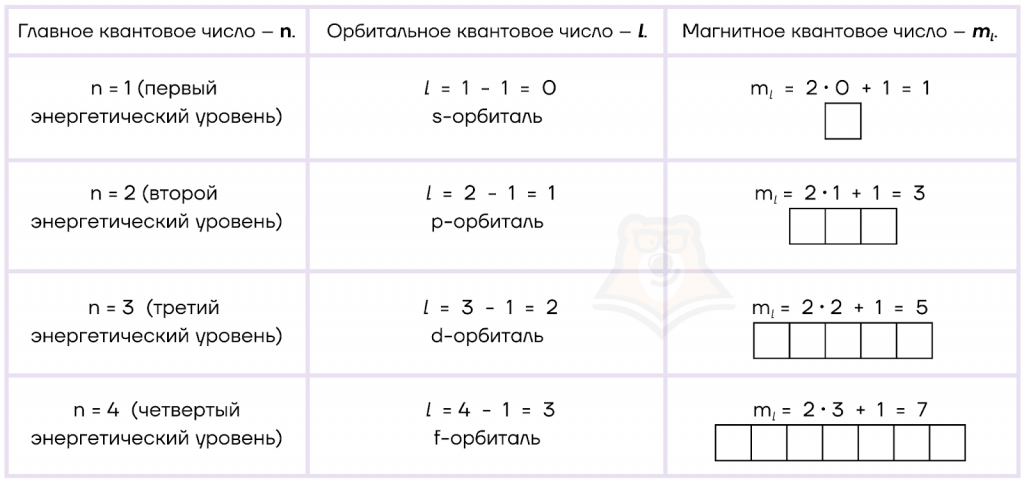
Главное квантовое число (n) характеризует номер энергетического уровня атома.
Главное квантовое число численно равно номеру периода.
Принимает значения: 1, 2, 3,….∞. Однако на сегодняшний день максимальным главным квантовым числом является 7, так как в таблице Менделеева всего 7 периодов. Например, главное квантовое число атома фосфора (P) равно трем, так как этот элемент находится в третьем периоде.
Орбитальное квантовое число (l), или его еще называют побочным квантовым числом, определяет форму атомных орбиталей (траекторий движения электрона).
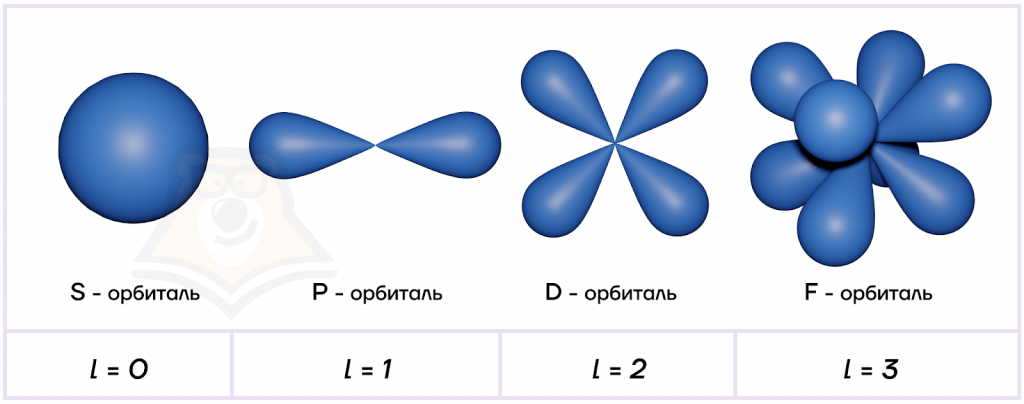
Определить l можно по формуле:
l=n-1, гдеn — это главное квантовое число.
Максимально возможное орбитальное число всегда будет на единицу меньше главного квантового числа.

Важно помнить, что количество атомных орбиталей на каждом уровне равно номеру этого уровня.
Например, фосфор, находящийся в третьем периоде, имеет на первом энергетическом уровне одну атомную орбиталь (s), на втором — две (s и p), на третьем — три (s, p и d). То есть атом фосфора имеет три разных по энергии, но одинаковые по форме s-орбитали – на первом, втором и третьем энергетических уровнях.
Магнитное квантовое число (ml) определяет количество атомных орбиталей (ячеек).
Оно рассчитывается по формуле:
ml =2l+1, гдеl – это орбитальное квантовое число.
Например, у атома фосфора главное квантовое число n=3; орбитальное квантовое число l=3-1=2 (d-орбиталь); магнитное квантовое число ml =2 · 2+1=5. Таким образом делаем вывод, что на третьем (n) энергетическом уровне у фосфора находится пять (ml) различных по энергии d-орбиталей (l).
Спиновое квантовое число (ms) характеризует собственное движение электрона — спин.
Как мы уже сказали, спиновое квантовое число характеризует движение электрона вокруг ядра атома. То есть атом может двигаться как по часовой, так и против часовой стрелки. Это очень напоминает спиннер (вращающаяся игрушка). Более того, понятия «спиновый» и «спиннер» созвучны, что позволяет без труда вспомнить смысл этого квантового числа.

Расчеты главного, орбитального и магнитного квантовых чисел приведены в таблице.
Квантовые числа позволяют нам собрать информацию о строении атома химического элемента, о распределении его электронов, чтобы затем составить «паспорт».
Как обобществленные электроны используются в научных исследованиях
Одним из основных методов исследования с использованием обобществленных электронов является электронная спектроскопия. Этот метод позволяет изучать свойства и структуру различных материалов на атомном уровне. С помощью спектроскопии можно определить химический состав образца, его электронную структуру и магнитные свойства. Благодаря этому исследователи могут более глубоко понять природу материалов и разрабатывать новые материалы с определенными свойствами.
Также обобществленные электроны используются в исследованиях в области поверхности материалов. С помощью техник, таких как сканирующая туннельная микроскопия (STM) и электронная микроскопия с полемионизацией (PEEM), исследователи могут изучать атомную и молекулярную структуру поверхности материалов и наноструктур. Это позволяет получить информацию о рельефе поверхности, размере и форме наночастиц, а также изучать взаимодействие между различными материалами на поверхности.
Кроме того, обобществленные электроны применяются в физике конденсированного состояния для изучения оптических и электронных свойств различных материалов. В частности, они используются в исследованиях полупроводников, металлов, магнетиков и других функциональных материалов. Это позволяет исследователям более полно понять механизмы транспорта зарядов в материалах и создать новые устройства с улучшенными электронными свойствами.
Таким образом, обобществленные электроны являются мощным инструментом для исследования различных свойств и структуры материалов на наноуровне. Они находят широкое применение в различных областях науки и способствуют развитию новых материалов и технологий.
Обобществление внешних электронов
Обобществление внешних электронов играет важную роль в механизме металлической связи и определяет структуру металлов. Все металлы имеют общую особенность – наличие свободных электронов в валентной зоне. Внешние электроны металла легко движутся по кристаллической решетке, образуя своего рода «электронное облако».
Внешние электроны обладают свойством обобществляться, то есть они формируют электронный газ, обхватывающий катионные ядра металлической решетки. Это явление называется коллективизацией электронов. В результате обобществления внешних электронов металлы приобретают свои основные характеристики, такие как высокая теплопроводность, электропроводность и пластичность.
Свободные электроны активно участвуют в проведении электрического тока и тепла. Они движутся в металлической решетке, перенося электрический заряд и теплоотдачу. Чем больше вещество содержит свободных электронов, тем лучше оно проводит электричество или тепло. Это объясняет высокую электропроводность и теплопроводность металлов.
Помимо этого, коллективное движение электронов обуславливает пластичность металлов. Внешние электроны придерживаются катионных ядер, но одновременно свободно перемещаются по кристаллической решетке. Это делает металлы тугоплавкими, способными к деформации. Металлы могут быть легко обработаны, раскатаны и растянуты без разрушения своей структуры.
Опыт Мандельштама и Папалекси
Электронную природу тока в металле первыми экспериментально доказали российские физики Мандельштам и Папалекси в 1913 г. Для того, чтобы выяснить, какие частицы создают электрический ток в металлах, они — без подключения внешнего источника — регистрировали ток в катушке из металлического провода, которую сначала сильно раскручивали вокруг собственной оси, а затем резко останавливали. Поскольку у электрона есть масса, то он должен подчиняться закону инерции. Поэтому в момент остановки атомы решетки останутся на месте, а свободные электроны по инерции, какое-то время, продолжат движение в прежнем направлении. То есть в цепи должен появиться электрический ток. Эксперименты подтвердил это предположение — после остановки катушки исследователи регистрировали бросок тока в цепи.
Рис. 2. Опыт Мандельштама и Папалекси.
Этот эксперимент в 1916 г. повторили американцы Стюарт и Толмен. Им удалось повысить точность измерений и получить отношение заряда электрона eэ к значению массы электрона mэ:
$$ {e_э \over m_э } = 1,8*10^{11} Кл/кг $$
Этот фундаментальный результат совпал с полученными данными из других экспериментов, поставленных на основе измерения других параметров. Впервые эту величину в 1897 г. измерил англичанин Джозеф Томсон по отклонению пучка электронов в зависимости от напряженности электрического поля.
Примеры обобществления электронов
Обобществление электронов — это явление, при котором электроны вещества образуют общую систему, взаимодействуя друг с другом и обладая определенными свойствами и поведением. Вот несколько примеров обобществления электронов:
-
Металлы: В металлах, таких как железо, алюминий или медь, электроны обобществляются, образуя электронное облако вокруг положительных ионов. Это позволяет металлам быть хорошими проводниками электричества и тепла.
Металл Число валентных электронов Железо (Fe) 2 Алюминий (Al) 3 Медь (Cu) 1 -
Полупроводники: В полупроводниках, таких как кремний или германий, электроны также обобществляются, но в меньшей степени, чем в металлах. Это создает зону электронной проводимости, которая может быть заполнена или разрежена в зависимости от внешних условий и примесей. Полупроводники находят применение в электронике и солнечных батареях.
- Кремний (Si)
- Германий (Ge)
-
Индивидуальные электроны: В природе существуют случаи, когда электроны не обобществляются и действуют независимо друг от друга. К таким случаям относятся свободные электроны в атмосфере Земли или электроны в атомах газов.
Обобществление электронов играет важную роль в множестве физических явлений и технологий, таких как электрическая проводимость, электроника и фотоника.
Проверь себя
Задание 1.Из чего состоит ядро атома?
- Протонов и нейтронов
- Протонов и электронов
- Нейтронов и электронов
- Протонов, нейтронов и электронов
Задание 2.Количество каких элементарных частиц отличается у изотопов?
- Протонов
- Нейтронов
- Электронов
- Нейтронов и электронов
Задание 3.Сколько электронов может максимально находиться на 3 энергетическом уровне?
- 8 электронов
- 18 электронов
- 2 электрона
- 32 электрона
Задание 4.Какой из энергетических уровней можно назвать внешним?
- Первый энергетический уровень
- Последний энергетический уровень
- Энергетический уровень с наименьшей энергией
- Любой энергетический уровень
Задание 5.Чему равно количество валентных электронов для элементов главных подгрупп?
- Номеру группы
- Номеру периода
- Порядковому номеру элемента
- Массовому числу элемента
Ответы: 1. — 1; 2. — 2; 3. — 2; 4. — 2; 5. — 1
Формирование электронных обществ
Формирование электронных обществ – это процесс создания групп или сообществ, основанных на совместном использовании информационных технологий и цифровых платформ.
В современном мире электронные общества становятся все более популярными и востребованными. Это связано с развитием интернета и цифровых технологий, которые позволяют людям быстро и эффективно обмениваться информацией, взаимодействовать и сотрудничать.
Формирование электронных обществ происходит по разным причинам. В некоторых случаях люди объединяются, чтобы решить конкретные задачи или достичь общих целей. Например, это может быть создание совместного проекта, разработка программного обеспечения или проведение массовых онлайн-обучений.
Другие электронные общества могут формироваться вокруг общих интересов, хобби или увлечений. Например, это могут быть сообщества людей, занимающихся фотографией, музыкой, спортом или искусством. Такие общества предоставляют участникам возможность обмениваться опытом, получать поддержку и вдохновение от единомышленников.
Важной составляющей формирования электронных обществ является платформа, на которой они функционируют. Это может быть специальный веб-сайт, социальная сеть, форум или мессенджер
Платформы предоставляют участникам общества инструменты для коммуникации, совместной работы и обмена информацией.
Создание электронных обществ позволяет людям расширить свои возможности и ресурсы за счет совместного действия. Они могут получать помощь, советы или экспертное мнение от других участников, обмениваться знаниями и опытом, а также находить новые возможности для реализации своих интересов и целей.
Однако формирование электронных обществ также может столкнуться с некоторыми проблемами и сложностями. Например, это могут быть проблемы с коммуникацией и координацией деятельности участников, трудности в решении конфликтов или несоответствие ожиданий между участниками.
В целом, формирование электронных обществ представляет собой важный аспект современной общественной жизни. Они открывают новые возможности для взаимодействия, обучения и сотрудничества, а также способствуют развитию коллективного интеллекта и креативных идей.
Фактчек
- Атом — электронейтральная частица, состоящая из ядра и вращающихся вокруг него электронов.
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Существует группа атомов одного и того же химического элемента, у которых имеется разное число нейтронов. Такие элементы называют изотопами.
- Электроны характеризуются 4 квантовыми числами: n — главное квантовое число, l — орбитальное квантовое число, ml — магнитное квантовое число, ms — спиновое квантовое число.
- Электроны располагаются по ячейкам так, чтобы энергия системы была минимальна.
- Атом стремится обладать наиболее устойчивой электронной конфигурацией, при которой внешний энергетический уровень/подуровень является заполненным. Если к нейтральному атому добавить электроны, то он превращается в анион, если же у него отобрать электроны — образуется катион.
- Для элементов главных подгрупп валентными являются все электроны внешнего уровня. Для элементов побочных подгрупп — это электроны внешнего слоя и предвнешнего d-подуровня.
Цели и принципы обобществления
Цель обобществления – создание и развитие инфраструктуры, которая позволяет электронам вступать во взаимодействие друг с другом и образовывать коллективное поведение. Это позволяет повысить эффективность работы и раскрыть потенциал электронов.
Принципы обобществления:
- Коллективность: обобществление предполагает сотрудничество и взаимодействие электронов внутри общей среды. Они объединяются в группы и коммуницируют друг с другом для достижения общих целей.
- Открытость: обобществление стремится к принятию новых электронов и интеграции их в существующую среду. Это создает условия для обмена знаниями, опытом и идеями.
- Взаимодействие: обобществление основано на взаимодействии между электронами и другими системами. Они могут обмениваться информацией, ресурсами и влиять друг на друга.
- Самоорганизация: обобществление способно самоорганизовываться, адаптироваться к изменяющимся условиям и принимать решения в интересах общего блага.
- Распределенность: обобществление может существовать в разных местах и пространствах, включая виртуальную среду. Нет ограничений на географическую локацию.
Принципы обобществления позволяют электронам эффективно работать вместе, обмениваться информацией и ресурсами, а также развиваться и приспосабливаться к изменяющимся условиям окружающей среды.
Электростатическая индукция
Кажется, с электризацией разобрались. Теперь разберемся, что произойдет, если мы поднесем одно тело к другому, но не вплотную. Произойдет такое явление, как электростатическая индукция — явление перераспределения зарядов в нейтрально заряженных телах.
Давай разбираться на примере задачи:
На нити подвешен незаряженный металлический шарик. К нему снизу поднесли положительно заряженную палочку. Как изменится при этом сила натяжения нити?
Решение:
Здесь важно подчеркнуть, что незаряженный — значит заряжен нейтрально. То есть в теле равное количество положительных и отрицательных зарядов
Электроны металлического шарика будут перемещаться вниз и притягиваться к поднесенной положительной палочке. В результате шарик притягивается к палочке, следовательно, сила натяжения нити увеличивается.
Ответ: сила натяжения нити увеличивается
Скорость распространения электрического тока
Скорость распространения электрического поля в металле близка к скорости света в вакууме, которая равна 300000 км/с. Но это не значит, что электроны внутри вещества двигаются с такой же скоростью. Для проводника с площадью поперечного сечения S = 1 мм2 при силе тока I = 1 A скорость упорядоченного движения электронов равна v = 6*10-5 м/с. То есть за одну секунду электроны в проводнике за счет упорядоченного движения проходят всего 0,06 мм.
Такие малые значения скоростей движения электронов в проводниках не приводят к запаздыванию включения электрических ламп, включения бытовых приборов и т.д., так как при подаче напряжения вдоль проводов со скоростью света распространяется электрическое поле. Эта скорость настолько велика, что позволяет приводить в движение свободные электроны практически мгновенно во всех проводниках электрической цепи.
Презентация на тему: » Ковалентная связь (от латинского «со» совместно и «vales» имеющий силу) осуществляется за счет электронной пары, принадлежащей обоим атомам. Образуется.» — Транскрипт:
1
Ковалентная связь (от латинского «со» совместно и «vales» имеющий силу) осуществляется за счет электронной пары, принадлежащей обоим атомам. Образуется между атомами неметаллов. Сайт учителя биологии и химии

2
В качестве примера- взаимодействие атомов водорода и хлора CI 1 s 2 2s 2 2 р 6 3s 2 Зр 5 -семь электронов на внешнем уровне Н 1s 1 — один электрон Каждому из двух атомов недостает по одному электрону для того, чтобы иметь завершенную внешнюю электронную оболочку.

3
Лучше всего изображать это с помощью формул Льюиса: Каждый из атомов выделяет «в общее пользование» по одному электрону. Правило октета оказывается выполненным.
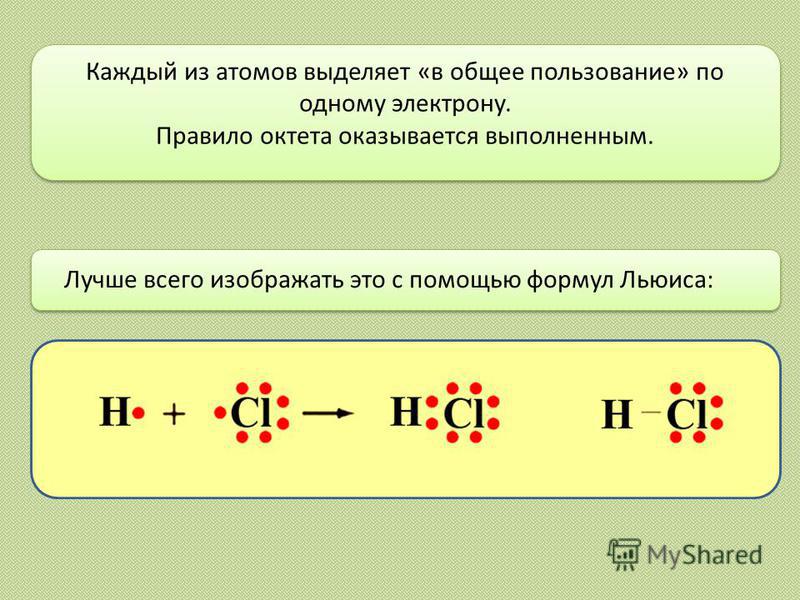
4
Обобществленные электроны принадлежат теперь обоим атомам. Атом водорода имеет два электрона (свой собственный и обобществленный электрон атома хлора), а атом хлора восемь электронов (свои плюс обобществленный электрон атома водорода). Эти два обобществленных электрона образуют ковалентную связь между атомами водорода и хлора

5
Образовавшаяся при связывании двух атомов частица называется молекулой.

6
Помимо одинарных связей может образовываться двойная или тройная ковалентная связь, как, например, в молекулах кислорода 0 2 или азота N 2.

7
Одним из редких исключений является алмаз, который плавится выше °С. Это объясняется строением алмаза, который представляет собой сплошную решетку ковалентно связанных атомов углерода, а не совокупность отдельных молекул. Любой кристалл алмаза представляет собой одну огромную молекулу. Ковалентные соединения обычно газы, жидкости или сравнительно низкоплавкие твердые вещества
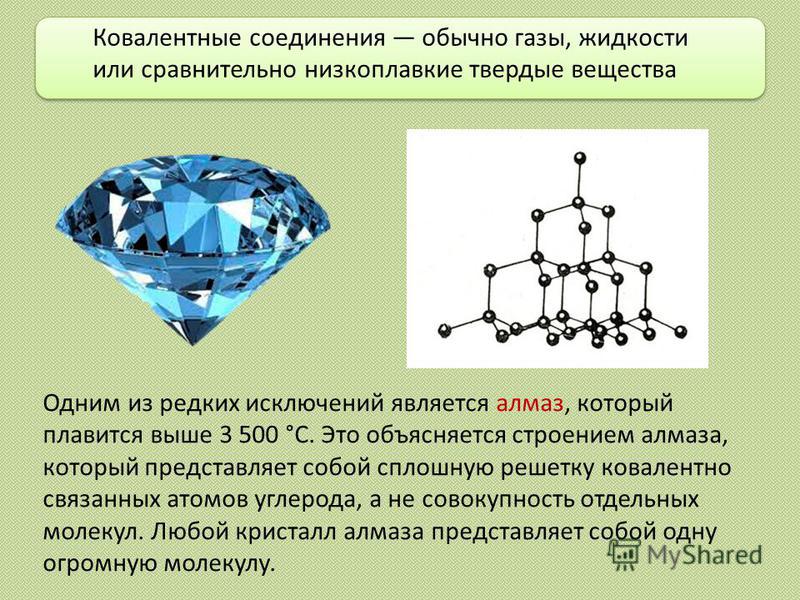
8
ПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ НЕПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ КОВАЛЕНТНАЯ ДОНОРНО- АКЦЕПТОРНАЯ СВЯЗЬ

9
У каждого атома водорода имеется электрон. При сближении двух атомов возникает такой момент, когда оба электрона будут находиться рядом. Что получается? НЕПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ У левого атома (зеленый) стало 2 электрона на орбитали очень выгодное энергетическое состояние, и у правого атома (синий) стало 2 электрона тоже выгодное состояние. Образуется молекула водорода. Образуется общая электронная пара

10
При образовании неполярной ковалентной связи плотность равномерно распределена между обоими атомами. Связывающие электроны в равной степени принадлежат обоим атомам. На атомах отсутствует заряд.

11
Образуются две электронные пары 2 ковалентные связи. ПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ Образование молекулы воды кислород добавляет себе пару электронов, что делает его электронную оболочку завершенной, каждый атом водорода тоже становится двухэлектронным у всех стабильное энергетическое состояние.
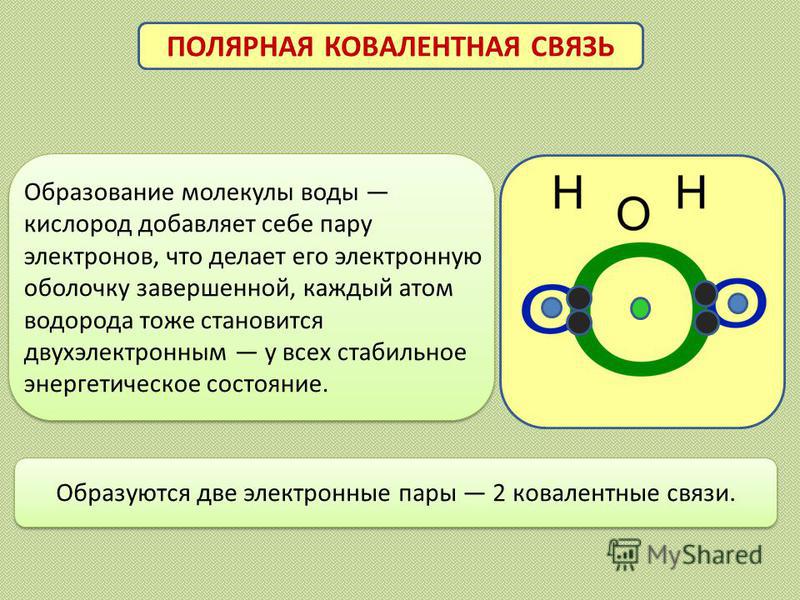
12
При образовании полярной ковалентной связи электронная плотность смещается в сторону одного из атомов. Поляризация возникает в следствии различия электроотрицательностей элементов в паре.

13
КОВАЛЕНТНАЯ ДОНОРНО- АКЦЕПТОРНАЯ СВЯЗЬ Донорно-акцепторный механизм способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемый за счет неподеленной пары электронов атома-донора и свободной орбитали атома-акцептора.

14
1. Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару.

15
2. Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.

16
Донорно-акцепторную ковалентную связь образуют атомы, имеющие неподеленную электронную пару доноры электронов (например, азот, кислород, фосфор, сера и т.д.) и атомы, образующие пустую орбиталь акцепторы (например, протон водорода и некоторые d- элементы). ИТОГ ПО ВИДАМ КОВАЛЕНТНОЙ СВЯЗИ: Ковалентную неполярную связь образуют одинаковые атомы неметаллов и атомы водорода; Ковалентную полярную химическую связь образуют разные атомы неметаллов и неметаллы с водородом;

Проскок электрона
Одной из главных особенностей переходных элементов является проскок электрона. Для начала поймем, что же это такое?
Провал (проскок) электрона — переход электрона с внешнего энергетического уровня на предвнешний (нижележащий).
| Как умеет скакать электрон?Иногда при заполнении энергетических подуровней мы нарушаем порядок заполнения подуровней. В первую очередь, это связано с заполнением s- и d-подуровней. Электрон перемещается с внешнего s- на предвнешний d-подуровень. Так образуется более устойчивая заполненная или полузаполненная конфигурация. Иметь такую конфигурацию более энергетически выгодно, поэтому происходит проскок (провал) электрона: электрон с верхнего «этажа» как будто проваливается на «этаж» ниже. |
Это явление характерно для элементов IB и VIB групп: хрома (Cr), меди (Cu), серебра (Ag), золота (Au). Также проскок имеется у ниобия (Nb), молибдена (Mo), рутения (Ru), платины (Pt) и палладия (Pd).
Например, у меди электронная оболочка должна выглядеть как ..3d94s2. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон «перепрыгивает» на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d104s1
Итог: иметь конфигурации nd5 и nd10 более энергетически выгодно, чем nd4 и nd9.
Закрепим тему, а для этого решим аналог задания №1 ЕГЭ.Задание. Определите, какие из указанных элементов в основном состоянии имеют на внешнем электронном уровне один неспаренный электрон. Запишите в поле ответа номера выбранных элементов в порядке возрастания.1) Cr2) Ca3) C4) Ne5) CuРешение: Запишем электронные конфигурации элементов.1) Конфигурация хрома с учетом проскока электрона: 1s2 2s2 2p6 3s2 3p6 4s1 3d5.Внешним считается 4 электронный уровень, на нем у нас один неспаренный электрон (4s1), вариант ответа нам подойдет.2) Конфигурация кальция: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s². Внешним будет 4 уровень, на нем два спаренных электрона (4s2).3) Конфигурация углерода: 1s2 2s2 2p2. Внешним будет 2 уровень, на котором два спаренных электрона (2s2) и два неспаренных (2p2).4) Конфигурация неона: 1s2 2s2 2p6. Благородные газы не имеют неспаренных электронов, их внешний уровень полностью заполнен.5) Конфигурация меди с учетом проскока электрона: 1s2 2s2 2p6 3s2 3p6 4s1 3d10. Внешним считается 4 электронный уровень, на нем у нас один неспаренный электрон (4s1), вариант ответа нам также подойдет.Ответ: 15
Сегодня мы с вами узнали, что электроны располагаются в атомах химических элементов в определенном порядке и выявили связь между положением химического элемента в Периодической системе химических элементов Д. И. Менделеева и строением его атома. Теперь для нас не составит труда описать строение атома любого химического элемента. А подробнее о переходных элементах можно прочитать в статье «Переходные элементы: хром, железо, марганец».
Одинарные, двойные и тройные связи
Если попросту, любая ковалентная связь — общая для двух атомов электронная пара. Электронов, которыми одному атому приходится делиться с другим, обычно столько, сколько их у атома на внешней оболочке. К примеру, поскольку у атома углерода на внешней оболочке четыре электрона, он может образовывать четыре электронные пары с другим атомом — или четыре связи. Способность углерода образовывать четыре связи обусловливает устройство практически всех органических (содержащих углерод) соединений, в которых углеродный скелет оснащен атомами других разновидностей: в длинных органических молекулах-цепочках электроны атомов углерода образуют пары с электронами других таких же атомов, а также часто — с атомами водорода. Однако иногда у двух атомов есть более одной общей электронной пары, то есть получается двойная связь углерод-углерод — или углерод-кислород. Бывают и тройные связи, когда у двух атомов три общие электронные пары, но три электрона на внешней оболочке есть у атомов далеко не всех элементов. У водорода, к примеру, всего один.


























