Типы химических реакций
Химические реакции можно классифицировать по различным признакам:
-
По числу и составу исходных веществ и продуктов реакции.
-
По изменению степени окисления.
-
По тепловому эффекту.
-
По агрегатному состоянию.
-
По наличию или отсутствию катализатора.
-
По обратимости.
По числу и составу исходных веществ и продуктов реакции
По этому признаку выделяют 4 типа реакций: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Реакции соединения — это реакции, в результате которых из нескольких более простых веществ образуется одно более сложное.
Например, простые вещества барий и кислород взаимодействуют с образованием сложного вещества оксида бария:
2Ba + O2 = 2BaO.
Также к реакциям соединения относится взаимодействие оксида натрия с водой с образованием более сложного вещества гидроксида натрия. Оно более сложное, так как состоит уже из трех атомов химических элементов, в отличие от веществ-реагентов, которые состоят из двух атомов:
Na2O + H2O = 2NaOH.
Реакции разложения — это реакции, в результате которых из одного более сложного вещества образуется несколько более простых веществ. Является процессом, обратным реакции соединения.
Пример такой реакции — разложение нитрата серебра на несколько более простых веществ: серебро, оксид азота (IV) и кислород.
Что это за стрелочка?
Стрелка вверх означает, что получившееся вещество является газом, который покидает место проведения реакции и больше не участвует в ней.
Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы одного химического элемента в сложном веществе. Также возможно замещение функциональных групп в сложном веществе.
Например, замещение атомов водорода в молекуле соляной кислоты на атомы цинка:
Реакции обмена — это реакции между двумя сложными веществами, в результате которых вещества обмениваются своими составными частями.
Например, NaOH + H2SO4 = Na2SO4 + H2O.
Реакции нейтрализации
Реакция щелочи с кислотой называется реакцией нейтрализации и является частным случаем реакции обмена.
Для наглядности показали все типы химических реакций по этому признаку на схеме:

По изменению степени окисления
По этому признаку выделяют два вида реакций:
-
реакции, протекающие без изменения степени окисления;
-
окислительно-восстановительные реакции (ОВР) — реакции, протекающие с изменением степени окисления нескольких элементов.
В ОВР всегда участвуют вещество-окислитель и вещество-восстановитель. Другие исходные вещества, принимающие участие в реакции, выступают в качестве среды, в которой протекает эта реакция.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции принимает электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции отдает электроны, тем самым повышая свою степень окисления.
Из определений можно сделать вывод, что в ходе реакции протекает два процесса: принятие электронов (восстановление) и отдача электронов (окисление). Протекают они одновременно.
По тепловому эффекту
По тепловому эффекту реакции делятся на эндотермические и экзотермические.
Эндотермические реакции протекают с поглощением теплоты (−Q). Буквой Q обозначается количество теплоты.
К таким реакциям относятся практически все реакции разложения. Пример:
CaCO3 = CaO + CO2 − Q.
Экзотермические реакции протекают с выделением теплоты (+Q).
К таким реакциям относятся практически все реакции соединения. Пример:
2H2 + O2 = 2H2O + Q.
По агрегатному состоянию исходных веществ
По этому признаку все реакции разделяют на гомогенные и гетерогенные.
Гомогенные реакции протекают в одной фазе.
К гомогенным реакциям относятся те, исходные вещества которых находятся либо в жидком агрегатном состоянии, либо в газообразном. Например, взаимодействие двух газообразных веществ — водорода и хлора:
H2(г) + Cl2(г) = 2HCl.
Агрегатное состояние указывается в правом нижнем углу: «г» — газообразное, «ж» — жидкое, «тв» — твердое.
Гетерогенные реакции протекают на границе раздела фаз.
Как правило, такие реакции протекают между веществами, которые находятся в разных агрегатных состояниях:
2Na(тв) + 2H2O(ж) = 2NaOH + H2.
Каталитические и некаталитические реакции. Самоподготовка к ЕГЭ и ЦТ по химии

Смотреть видео:
СМОТРЕТЬ ВИДЕОРОЛИК:
youtu.be/_eWoa0H3UtU
#химия #химияпросто #неорганика #егэпохимии #эксперименты #химик #егэхимия #химияегэ #chemistry
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:
Экзотермические и эндотермические реакции. Самоподготовка к ЕГЭ и ЦТ по химии
Your system education

Гомогенные и гетерогенные реакции. Самоподготовка к ЕГЭ и ЦТ по химии
Your system education

Обратимые и необратимые химические реакции. Самоподготовка к ЕГЭ и ЦТ по химии
Your system education

НЕОЧЕВИДНЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ В ОРГАНИКЕ | ЕГЭ Химия | Лия Менделеева
Лия Менделеева — ЕГЭ химия
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
27.06.2019
Исчерпывающее окисление
Существует относительно немного примеров расщепление двойной С = С связи перманганат-ионом (в нейтральной среде или в неводных органических растворах) с образованием альдегидов:
 Рисунок 2. Исчерпывающее окисление. Автор24 — интернет-биржа студенческих работ
Рисунок 2. Исчерпывающее окисление. Автор24 — интернет-биржа студенческих работ
Когда алкен окисляют избытком щелочного перманганата в случае крайнего расположения двойной связи будет образовываться кислота и углекислый газ:
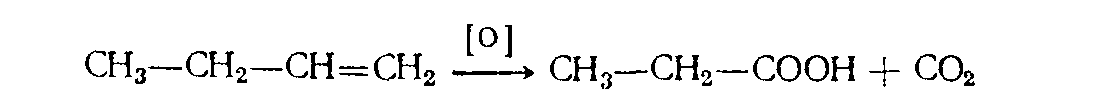 Рисунок 3. Исчерпывающее окисление. Автор24 — интернет-биржа студенческих работ
Рисунок 3. Исчерпывающее окисление. Автор24 — интернет-биржа студенческих работ
Некоторые ароматические альдегиды были получены окислением производных арилэтиленов, однако, в общем случае, реакция идет с хорошими выходами только тогда, когда в ароматическом альдегиде присутствуют электронакцепторные группы в орто- или пара-положениях к альдегидной группе. К примеру, натриевая соль 5-нитро-2-формилбензенсульфокислоты полученная с почти количественным выходом окислением динатриевой соли 4,4′-динитростильбен-2,2′-дисульфокислоты водным раствором перманганата:
 Рисунок 4. Исчерпывающее окисление. Автор24 — интернет-биржа студенческих работ
Рисунок 4. Исчерпывающее окисление. Автор24 — интернет-биржа студенческих работ
Бициклогепт-2-ен при обработке водным раствором перманганата в присутствии сульфата магния образует циклопентан-1,3-дикарбоальдегид с выходом 54-60%:
 Рисунок 5. Исчерпывающее окисление. Автор24 — интернет-биржа студенческих работ
Рисунок 5. Исчерпывающее окисление. Автор24 — интернет-биржа студенческих работ
Эту и аналогичные реакции окисления других алкенов можно провести в неводных органических растворителях с помощью агентов межфазного катализа. Так, перманганат калия растворяется в некоторых органических растворителях при наличии агентов, комплексующих катион, таких, как макроциклический полиэфир дициклогексано-18-краун-6. Раствор перманганата калия в бензоле, содержащий эквимолярные количества этого краун-эфира, является эффективным реагентом для расщепления двойной С = С связи. Примером реакции этого типа является окисление α-пинена в цис-пиноновую кислоту:
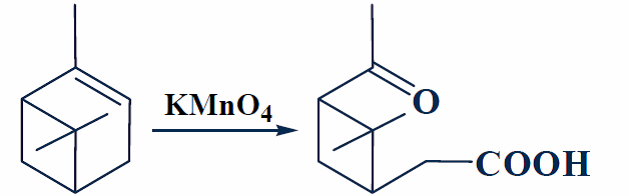 Рисунок 6. Исчерпывающее окисление. Автор24 — интернет-биржа студенческих работ
Рисунок 6. Исчерпывающее окисление. Автор24 — интернет-биржа студенческих работ
Аналогично действует хромилтрихлороацетат $CrO_2(OCOCCl_3)_2$ — этот реагент удобно получать в виде раствора в тетрахлорметане реакцией триоксида хрома с трихлоруксусным ангидридом и использовать для добычи диальдегида из циклических алкенов. По этому методу циклопентен, циклогексен, циклогептен и циклооктен превращаются в соответствующие диальдегиды:
 Рисунок 7. Исчерпывающее окисление. Автор24 — интернет-биржа студенческих работ
Рисунок 7. Исчерпывающее окисление. Автор24 — интернет-биржа студенческих работ
Кислотный катализ.
Каталитическая активность большого класса катализаторов обусловливается их кислотными свойствами. Согласно И.Брёнстеду и Т.Лоури, кислота – это соединение, способное отдавать протон. Сильные кислоты легко отдают свои протоны основаниям. Концепция кислотности получила дальнейшее развитие в работах Г.Льюиса, который дал определение кислоты как вещества, способного принимать электронную пару от вещества-донора с образованием ковалентной связи за счет обобществления этой электронной пары. Эти идеи вместе с представлениями о реакциях с образованием карбений-ионов помогли понять механизм разнообразных каталитических реакций, особенно тех, в которых участвуют углеводороды.
Силу кислоты можно определить с помощью набора оснований, изменяющих цвет при присоединении протона. Оказывается, некоторые промышленно важные катализаторы ведут себя как очень сильные кислоты. К ним относится катализатор процесса Фриделя – Крафтса, такой, как HCl-AlCl 2 O 3 (или HAlCl 4), и алюмосиликаты. Сила кислоты – это очень важная характеристика, поскольку от нее зависит скорость протонирования – ключевого этапа процесса кислотного катализа.
Активность таких катализаторов, как алюмосиликаты, применяющихся при крекинге нефти, определяется присутствием на их поверхности кислот Брёнстеда и Льюиса. Их структура аналогична структуре кремнезема (диоксида кремния), в котором часть атомов Si 4+ замещена атомами Al 3+ . Лишний отрицательный заряд, возникающий при этом, может быть нейтрализован соответствующими катионами. Если катионами являются протоны, то алюмосиликат ведет себя как кислота Брёнстеда:
Активность кислотных катализаторов обусловливается их способностью реагировать с углеводородами с образованием в качестве промежуточного продукта карбений-иона. Алкилкарбений-ионы содержат положительно заряженный углеродный атом, связанный с тремя алкильными группами и/или атомами водорода. Они играют важную роль как промежуточные продукты, образующиеся во многих реакциях с участием органических соединений. Механизм действия кислотных катализаторов можно проиллюстрировать на примере реакции изомеризации н
-бутана в изобутан в присутствии HCl-AlCl 3 или Pt-Cl-Al 2 O 3 . Сначала малое количество олефина С 4 Н 8 присоединяет положительно заряженный ион водорода кислотного катализатора с образованием третичного карбений-иона. Затем отрицательно заряженный гидрид-ион Н – отщепляется от н
-бутана с образованием изобутана и вторичного бутилкарбений-иона. Последний в результате перегруппировки превращается в третичный карбений-ион. Эта цепочка может продолжаться с отщеплением гидрид-иона от следующей молекулы н
-бутана и т.д.:
Существенно, что третичные карбений-ионы более стабильны, чем первичные или вторичные. Вследствие этого на поверхности катализатора присутствуют в основном именно они, а потому основным продуктом изомеризации бутана является изобутан.
Кислотные катализаторы широко применяются при переработке нефти – крекинге, алкилировании, полимеризации и изомеризации углеводородов . Установлен механизм действия карбений-ионов, играющих роль катализаторов в этих процессах. При этом они участвуют в целом ряде реакций, включая образование малых молекул путем расщепления больших, соединение молекул (олефина с олефином или олефина с изопарафином), структурную перегруппировку путем изомеризации, образование парафинов и ароматических углеводородов путем переноса водорода.
Одно из последних применений кислотного катализа в промышленности – получение этилированных топлив присоединением спиртов к изобутилену или изоамилену. Добавление кислородсодержащих соединений в бензин уменьшает концентрацию оксида углерода в выхлопных газах. Метил-трет
-бутиловый эфир (МТБЭ) с октановым числом смешения 109 тоже позволяет получить высокооктановое топливо, необходимое для работы автомобильного двигателя с высокой степенью сжатия, не прибегая к введению в бензин тетраэтилсвинца. Организовано также производство топлив с октановыми числами 102 и 111.
Получение одноатомных cпиртов
Гидратация алкенов
В присутствии сильных минеральных кислот, алкены вступают в реакцию гидратации с образованием спиртов:
В случае несимметричных алкенов присоединение происходит в соответствии с правилом Марковникова – атом водорода молекулы воды присоединяется к более гидрированному атому углерода, а гидрокси-группа к менее гидрированному при двойной связи:
Гидрирование (восстановление) альдегидов и кетонов
Гидрирование альдегидов на металлических катализаторах (Pt, Pd или Ni) при нагревании приводит к образованию первичных спиртов:
В аналогичных условиях из кетонов получаются вторичные спирты:
Гидролиз сложных эфиров
При действии на сложные эфиры сильных минеральных кислот они подвергаются гидролизу с образованием спирта и карбоновой кислоты:
Гидролиз сложных эфиров в присутствии щелочей называют омылением. Данный процесс является необратимым и приводит к образованию спирта и соли карбоновой кислоты:
Данный процесс протекает по действием на моногалогенпроизводные углеводородов водного раствора щелочи:
Спиртовое брожение глюкозы
В присутствии некоторых дрожжей, точнее под действием вырабатываемых ими ферментов, возможно образование этилового спирта из глюкозы. При этом в качестве побочного продукта образуется также углекислый газ:
Получение метанола из синтез-газа
Синтез-газом называют смесь угарного газа и водорода. Действием на данную смесь катализаторов, нагрева и повышенных давлений в промышленности получают метанол:
Теории катализа.
Для объяснения механизма каталитических реакций были предложены три группы теорий: геометрические, электронные и химическая
В геометрических теориях основное внимание обращено на соответствие между геометрической конфигурацией атомов активных центров катализатора и атомов той части реагирующих молекул, которая ответственна за связывание с катализатором. Электронные теории исходят из представления, что хемосорбция обусловливается электронным взаимодействием, связанным с переносом заряда, т.е
эти теории связывают каталитическую активность с электронными свойствами катализатора. Химическая теория рассматривает катализатор как химическое соединение с характерными свойствами, которое образует химические связи с реагентами, в результате чего формируется нестабильный переходный комплекс. После распада комплекса с высвобождением продуктов катализатор возвращается в исходное состояние. Последняя теория считается сейчас наиболее адекватной.
На молекулярном уровне каталитическую газофазную реакцию можно представить следующим образом. Одна реагирующая молекула связывается с активным центром катализатора, а другая взаимодействует с ней, находясь непосредственно в газовой фазе. Возможен и альтернативный механизм: реагирующие молекулы адсорбируются на соседних активных центрах катализатора, а потом взаимодействуют друг с другом. По-видимому, именно таким образом протекает большинство каталитических реакций.
Другая концепция предполагает, что существует связь между пространственным расположением атомов на поверхности катализатора и его каталитической активностью. Скорость одних каталитических процессов, в том числе многих реакций гидрирования, не зависит от взаимного расположения каталитически активных атомов на поверхности; скорость других, напротив, существенно изменяется при изменении пространственной конфигурации поверхностных атомов. В качестве примера можно привести изомеризацию неопентана в изопентан и одновременный крекинг последнего до изобутана и метана на поверхности катализатора Pt-Al 2 O 3 .
Метод — каталитическое окисление
Метод каталитического окисления основан на каталитическом воздействии сераорганических соединений с кислородом и образовании легкоудаляемых соединений серы либо элементарной серы.
Метод каталитического окисления заключается в том, что над дегидрирующими катализаторами пары спирта пропускают в смеси с воздухом при температуре 500 — 600 С. При дегидрировании спирта образуются ацетальдегид и водород, последний немедленно окисляется кислородом воздуха в воду.
|
Схема установки очистки отходящих газов в производстве олифы. |
Метод каталитического окисления по сравнению с описанными выше является более простым в аппаратурном оформлении и позволяет обеспечить полную очистку газовых выбросов.
Метод межфазного каталитического окисления с помощью КМпО4 свободен от этих недостатков.
|
Схема производства двухатомных фенолов некаталитическим окислением диалкилбензолов ( фирма Distillers Co. |
Метод каталитического окисления диалкилбензолов разработан фирмой Goodyear-Rubber. Этой фирмой освоено производство гидрохинона ( 1 4-диокси-бензола) через дигидроперекись л-диизопропилбензола на установке мощностью 3000 т / год.
Разработан метод каталитического окисления пиридиновых соединений, содержащихся в сточных водах производства диви-нилметилвинилпиридинового каучука.
Использование метода каталитического окисления позволяет полностью очистить газовые выбросы от таких примесей, как масляный альдегид, ацетон, метиловый, этиловый, пропиловый и диа цетоновый спирты, фенол, толуол, ксилол, уайт-спирит, изоциана-ты, непредельные мономеры и др.. Очень эффективным оказалось применение в этом методе очистки медно-хромового катализатора, состоящего из смеси хромата ( 60 %) и хромита ( 30 %) меди с добавками оксидов меди, хрома и кальция. Процесс окисления ( до COz и воды) большинства перечисленных выше веществ происходит при 250 — 350 С.
Получают методом каталитического окисления циклогексана
Получается методом каталитического окисления бензола или нефтяных фракций.
Получается методом каталитического окисления бензола или нефтяных фракций.
Давно известен также метод каталитического окисления циклогексана в циклогексанол и цикло-гексанон кислородом воздуха ( ср. Таким образом, циклогексан, выделяемый из нефти, может быть непосредственно использован для синтеза капролактама.
Фирма Монсанто рекомендует метод каталитического окисления сернистого ангидрида с использованием ванадиевого катализатора для электростанций с установкой высокотемпературного ( 450 — 500 С) электрофильтра и контактного аппарата перед экономайзером.
В связи с развитием методов каталитического окисления пропилена акролеин является потенциально дешевым и доступным мономером.
Зачем нужен катализатор в промышленности
Катализаторы играют важную роль в промышленности, поскольку они ускоряют химические реакции, снижают температуру и давление, необходимые для проведения реакции, повышают конверсию реагентов и улучшают качество конечного продукта. Кроме того, катализаторы позволяют проводить реакции при низких температурах, что позволяет сэкономить энергию и снизить затраты на оборудование.
В некоторых процессах, например, в производстве синтетических материалов, катализаторы используются для снижения выбросов вредных веществ в окружающую среду. Это позволяет предотвратить загрязнение окружающей среды и защитить здоровье людей.
Кроме того, катализаторы могут быть использованы для восстановления отработанных катализаторов, что позволяет сэкономить сырьевые материалы и снизить затраты на производство.
Также катализаторы могут использоваться в различных процессах очистки воды, утилизации отходов и др.
Кроме того, катализаторы играют важную роль в экологически чистых технологиях. Они позволяют уменьшать выбросы вредных веществ в атмосферу и снижать негативное воздействие производственных отходов на окружающую среду. Катализаторы используются для очистки воды и воздуха, а также для утилизации отходов. Они способны ускорять процессы, которые необходимы для разложения вредных веществ на более безопасные компоненты.
Катализаторы могут быть различных типов, например, гетерогенные, гомогенные, ферментные, биологические и т. д. Каждый тип катализатора имеет свои особенности и применяется в зависимости от типа реакции и условий ее проведения. Например, гетерогенные катализаторы, которые используются наиболее часто, представляют собой твердые вещества, размещенные на поверхности реакционной среды. Гомогенные катализаторы, напротив, растворены в реакционной среде и обладают высокой активностью. Ферментные катализаторы используются в биохимии, а биологические катализаторы – в живых организмах.
Таким образом, катализаторы являются важным инструментом в химической промышленности и современных технологиях. Их использование позволяет улучшать производственные процессы, сокращать затраты и снижать вредное воздействие на окружающую среду. Без катализаторов современная промышленность была бы невозможна, и будущее связано с поиском новых и более эффективных катализаторов для различных процессов.
Промышленные каталитические нейтрализаторы
Каталитический нейтрализатор, представляющий собой систему очистки отработавших газов, установленный на генераторной станции, специальной технике обеспечивает степень очистки отработавших газов ДВС:
- по оксиду углерода (CO) – 90-97%;
- по углеводородам (CH) – 85-95%;
- по оксидам азота (NOx) – 65-95%;
- по содержанию твердых частиц (саже, РМ) – 85-95%.
Система очистки отработавших (выхлопных) газов может состоять из трех последовательных ступеней, в зависимости от требований производства:
Сажевый фильтр.
Мелкие частицы сажи, образующиеся в двигателе внутреннего сгорания, могут оказывать канцерогенное действие, если они прикрепляются к легочной ткани. Волокнистый сажевый фильтр может фильтровать мелкие частицы отработавших газов. Частицы сгорают при рабочей температуре внутри системы на пропитанной катализатором поверхности волокна.
Сажа, осаждаемая на фильтре, состоит в основном из частиц углерода (C) и углеводородов. Существует два основных метода удаления частиц:
1. сгорание с кислородом (O2): + O2 → CO 2 2. сгорание с диоксидом азота (NO2): + NO2 → CO2 + NO
Характеристики двух разных методов отражены в таблице:

Регенерация на основе O2 Регенерация на основе NO2 Температура, необходимая для регенерации Требуется температура около 600 °C (или 400 °C с топливным катализатором). Реакция происходит от 250 °С. Используемый газ O2 в потоке выхлопных газов. NO2 должен быть воспроизведен из NO в потоке выхлопных газов.
Оборудование для селективного каталитического восстановления оксидов азота (NOx).
Этот процесс используется для уменьшения оксидов азота, образующихся во время процесса сгорания углеводородного топлива, сопровождающегося выделением энергии. NO (оксид азота) представляет собой бесцветный газ, который окисляется в воздухе с образованием NO2 (диоксид азота). В высоких концентратах он вызывает симптомы паралича нервной системы. NO2 — красно-коричневый газ с резким запахом. Под воздействием солнечного света и углеводородами, образует смог. Оксиды азота восстанавливаются в кислородсодержащих выхлопных газах с помощью процесса SCR (Selective Catalytic Reduction, селективное/выборочное каталитическое восстановление). Отработавший газ, обработанный дозированным реагентом мочевины, проходит через тонкостенные сотовые преобразователи, восстанавливая оксиды до воды и азота. Процесс с мочевиной – выгодная альтернатива аммиаку в качестве реагента для снижения уровня отравляющих веществ в выхлопных газах двигателя. По сравнению с аналогом реагент обладает значительными преимуществами в отношении транспортировки, хранения и обработки, при этом она значительно дешевле.
Оборудование для каталитического окисления СО и несгоревших углеводородов.
Этот процесс используется для снижения уровня окиси углерода и несгоревших углеводородов в выхлопных газах. Это достигается путем каталитического окисления. Такой катализатор может быть установлен после стадии SCR. Несгоревшие углеводороды могут быть обнаружены в выхлопных газах двигателей внутреннего сгорания. Такие выхлопные газы содержат различные вещества с различными свойствами:
Насыщенные углеводороды (парафины) практически не имеют запаха и могут оказывать слабое наркотическое действие.
Ненасыщенные углеводороды (олефины, ацетилены) – одна из составляющих городского смога.
Ароматические углеводороды представляют собой нервно-паралитические яды с наркотическим эффектом, а некоторые служат канцерогенными альдегидами с резким запахом и даже в низких концентрациях сильно раздражают слизистые глаз и носа.
Системы очистки выхлопных газов могут быть установлены как на стационарном, так и на мобильном оборудовании на первичных двигателях внутреннего сгорания, работающих на газе и жидком топливе.

Аммиак.
Один из самых простых с химической точки зрения процессов гидрирования – синтез аммиака из водорода и азота. Азот весьма инертное вещество. Для разрыва связи N–N в его молекуле необходима энергия порядка 200 ккал/моль. Однако азот связывается с поверхностью железного катализатора в атомарном состоянии, и для этого нужно всего 20 ккал/моль. Водород связывается с железом еще более охотно. Синтез аммиака протекает следующим образом:
Этот пример иллюстрирует способность катализатора ускорять в равной степени как прямую, так и обратную реакцию, т.е. тот факт, что катализатор не изменяет положение равновесия химической реакции.
↑рЕМДЕМЖХХ ПЮГБХРХЪ ЙЮРЮКХРХВЕЯЙНИ УХЛХХ
мЕЯЛНРПЪ МЮ РН, ВРН ЙЮРЮКХРХВЕЯЙЮЪ УХЛХЪ ЯТНПЛХПНБЮКЮЯЭ ЙЮЙ МЮСВМНЕ МЮОПЮБКЕМХЕ СФЕ АНКЕЕ ЯРЮ КЕР, МЕПЕЬ╦ММШУ ОПНАКЕЛ Б ЩРНИ МЮСЙЕ АНКЭЬЕ, ВЕЛ ПЕЬ╦ММШУ.
сВ╦МШЕ ОНЙЮ МЕ СЛЕЧР ОПЕДЯЙЮГШБЮРЭ ЙЮРЮКХРХВЕЯЙХЕ ЯБНИЯРБЮ УХЛХВЕЯЙХУ БЕЫЕЯРБ; РНКЭЙН Б ПЕДЙХУ ЯКСВЮЪУ ХЛ СДЮ╦РЯЪ ОНКСВЮРЭ ЙЮРЮКХГЮРНПШ, НАКЮДЮЧЫХЕ 100%-И ЯЕКЕЙРХБМНЯРЭЧ; МЕ ПЕЬЕМЮ ГЮДЮВЮ ГЮЛЕМШ Б ЯНЯРЮБЕ ЙЮРЮКХГЮРНПНБ ДНПНЦХУ АКЮЦНПНДМШУ ЛЕРЮККНБ МЮ АНКЕЕ ДЕЬ╦БШЕ ОЕПЕУНДМШЕ ЛЕРЮККШ; ЛЮКН ХГБЕЯРМН Н ДЕИЯРБХХ ЩКЕЙРПНЛЮЦМХРМШУ ХГКСВЕМХИ МЮ ОПНЖЕЯЯ ЙЮРЮКХГЮ. щРХ ГЮДЮВХ ЪБКЪЧРЯЪ ОПЕДЛЕРНЛ ХМРЕМЯХБМШУ ХЯЯКЕДНБЮМХИ ЙЮРЮКХРХЙНБ.
яПЕДХ ДПСЦХУ ЮЙРСЮКЭМШУ МЮОПЮБКЕМХИ ПЮГБХРХЪ ЙЮРЮКХРХВЕЯЙНИ УХЛХХ ЯКЕДСЕР НРЛЕРХРЭ ЛЕЛАПЮММШИ ЙЮРЮКХГ, ЙНЦДЮ ЛЕЛАПЮМЮ, ХЛЕЧЫЮЪ ОНПШ ЛНКЕЙСКЪПМНЦН ЛЮЯЬРЮАЮ, ОНЙПШРЮ Я НДМНИ ЯРНПНМШ ЙЮРЮКХГЮРНПНЛ. б ЩРНЛ ЯКСВЮЕ СДЮ╦РЯЪ ПЕГЙН ОНБШЯХРЭ ЯЕКЕЙРХБМНЯРЭ ОПНЖЕЯЯЮ, РЮЙ ЙЮЙ ОПЕБПЮЫЕМХЕ ОПЕРЕПОЕБЮЕР РНКЭЙН РН БЕЫЕЯРБН, ПЮГЛЕП ЛНКЕЙСК ЙНРНПНЦН ОНГБНКЪЕР ОПНМХЙМСРЭ ЯЙБНГЭ ЛЕЛАПЮМС. дПСЦНИ БЮПХЮМР ЛЕЛАПЮММНЦН ЙЮРЮКХГЮ ГЮЙКЧВЮЕРЯЪ Б ХЯОНКЭГНБЮМХХ Б ЙЮВЕЯРБЕ ЛЕЛАПЮМ РНМЙХУ ЯКН╦Б ОЮККЮДХЪ ХКХ ЯЕПЕАПЮ. щРХ ЛЕРЮККШ ОПХ МЮЦПЕБЮМХХ ОПНОСЯЙЮЧР БНДНПНД (Pd) ХКХ ЙХЯКНПНД (Ag). мЮ ПЮГМШУ ОНБЕПУМНЯРЪУ РЮЙХУ ЛЕЛАПЮМ ЛНФМН ОПНБНДХРЭ ЯНОПЪФ╦ММШЕ ПЕЮЙЖХХ, МЮОПХЛЕП ЦХДПХПНБЮМХЕ Х ДЕЦХДПХПНБЮМХЕ. б ПЕГСКЭРЮРЕ СДЮ╦РЯЪ ЯСЫЕЯРБЕММН ЯМХГХРЭ РЕЛОЕПЮРСПС ОПНЖЕЯЯЮ Х ОНБШЯХРЭ ЕЦН ЯЕКЕЙРХБМНЯРЭ.
б ОНЯКЕДМХЕ ЦНДШ ОНКСВХКХ ПЮЯОПНЯРПЮМЕМХЕ ХЯЯКЕДНБЮМХЪ ЙЮРЮКХРХВЕЯЙХУ ПЕЮЙЖХИ Б ЯПЕДЕ ЯБЕПУЙПХРХВЕЯЙХУ ПЮЯРБНПХРЕКЕИ, ОПЕФДЕ БЯЕЦН Б ЯПЕДЕ СЦКЕЙХЯКНЦН ЦЮГЮ, МЮУНДЪЫЕЦНЯЪ Б ЯБЕПУЙПХРХВЕЯЙНЛ ЯНЯРНЪМХХ. нФХДЮЕРЯЪ, ВРН, Я НДМНИ ЯРНПНМШ, ЩРН ЛНФЕР ОПХБЕЯРХ Й ОНБШЬЕМХЧ ЮЙРХБМНЯРХ Х ЯЕКЕЙРХБМНЯРХ ЙЮРЮКХГЮРНПНБ, Я ДПСЦНИ – Й ЯАЕПЕФЕМХЧ НЙПСФЮЧЫЕИ ЯПЕДШ, ОНЯЙНКЭЙС Б ОПНЖЕЯЯЕ МЕ ХЯОНКЭГСЧРЯЪ НПЦЮМХВЕЯЙХЕ ПЮЯРБНПХРЕКХ Х ДЮФЕ БНДЮ.
нОПЕДЕК╦ММШЕ МЮДЕФДШ ЙЮРЮКХРХЙХ БНГКЮЦЮЧР МЮ ХЯОНКЭГНБЮМХЕ Б ЙЮВЕЯРБЕ ПЮЯРБНПХРЕКЕИ РЮЙ МЮГШБЮЕЛШУ ХНММШУ ФХДЙНЯРЕИ – МЕКЕРСВХУ Х ЯХКЭМНОНКЪПМШУ ЯНЕДХМЕМХИ, ЯНДЕПФЮЫХУ ВЕРБЕПРХВМШИ ЙЮРХНМ ЮЛЛНМХЪ ХКХ ТНЯТНМХЪ Х ЙНЛОКЕЙЯМШИ ЮМХНМ. хНММШЕ ФХДЙНЯРХ, ЙЮЙ Х ЯБЕПУЙПХРХВЕЯЙХЕ ПЮЯРБНПХРЕКХ, ОНГБНКЪЧР ПЕГЙН СЛЕМЭЬХРЭ БПЕДМШЕ БШАПНЯШ.
мЮ УХЛХВЕЯЙНЛ ТЮЙСКЭРЕРЕ лцс ХЛ. л.б.кНЛНМНЯНБЮ ЙЮРЮКХРХВЕЯЙНИ УХЛХЕИ ГЮМХЛЮЧРЯЪ МЮ МЕЯЙНКЭЙХУ ЙЮТЕДПЮУ. щРН – ЙЮТЕДПШ ТХГХВЕЯЙНИ УХЛХХ, УХЛХХ МЕТРХ Х НПЦЮМХВЕЯЙНЦН ЙЮРЮКХГЮ, УХЛХВЕЯЙНИ ЙХМЕРХЙХ, УХЛХВЕЯЙНИ ЩМГХЛНКНЦХХ, УХЛХВЕЯЙНИ РЕУМНКНЦХХ Х МНБШУ ЛЮРЕПХЮКНБ. сВ╦МШЕ УХЛХВЕЯЙНЦН ТЮЙСКЭРЕРЮ ПЮГПЮАЮРШБЮЧР МНБШЕ РХОШ ЙЮРЮКХГЮРНПНБ ОПНЛШЬКЕММШУ ОПНЖЕЯЯНБ, СДЕКЪЪ ГМЮВХРЕКЭМНЕ БМХЛЮМХЕ ЛЕРЮККНЙНЛОКЕЙЯМНЛС Х ТЕПЛЕМРЮРХБМНЛС ЙЮРЮКХГС ЙЮЙ МЮХАНКЕЕ ОЕПЯОЕЙРХБМШЛ МЮОПЮБКЕМХЪЛ. хМРЕМЯХБМН ХГСВЮЧРЯЪ МНБШЕ ЖЕНКХРМШЕ ЙЮРЮКХГЮРНПШ МЕТРЕУХЛХВЕЯЙХУ ОПНЖЕЯЯНБ, Ю РЮЙФЕ МНБНЕ ОНЙНКЕМХЕ ЙЮРЮКХГЮРНПНБ ОНКХЛЕПХГЮЖХХ.
ПРИМЕНЕНИЕ КАТАЛИЗА В ПРОМЫШЛЕННОСТИ
Тот бурный промышленный рост, который мы сейчас переживаем, был бы невозможен без развития новых химических технологий. В значительной мере этот прогресс определяется широким применением катализаторов, с помощью которых низкосортное сырье превращается в высокоценные продукты. Образно говоря, катализатор – это философский камень современного алхимика, только он превращает не свинец в золото, а сырье в лекарства, пластмассы, химические реактивы, топливо, удобрения и другие полезные продукты.
Пожалуй, самый первый каталитический процесс, который человек научился использовать, – это брожение. Рецепты приготовления алкогольных напитков были известны шумерам еще за 3500 до н.э. См
. ВИНО; ПИВО.
Значительной вехой в практическом применении катализа стало производство маргарина каталитическим гидрированием растительного масла. Впервые эта реакция в промышленном масштабе была осуществлена примерно в 1900. А начиная с 1920-х годов один за другим были разработаны каталитические способы получения новых органических материалов, прежде всего пластмасс. Ключевым моментом стало каталитическое получение олефинов, нитрилов, эфиров, кислот и т.д. – «кирпичиков» для химического «строительства» пластмасс.
Третья волна промышленного использования каталитических процессов приходится на 1930-е годы и связана с переработкой нефти. По своему объему это производство вскоре оставило далеко позади все другие. Переработка нефти состоит из нескольких каталитических процессов: крекинга, риформинга, гидросульфирования, гидрокрекинга, изомеризации, полимеризации и алкилирования.
И наконец, четвертая волна в использовании катализа связана с охраной окружающей среды. Наиболее известное достижение в этой области – создание каталитического нейтрализатора выхлопных газов автомобилей. Каталитические нейтрализаторы, которые устанавливают на автомобили с 1975, сыграли большую роль в улучшении качества воздуха и сберегли таким образом много жизней.
За работы в области катализа и смежных областей было присуждено около десятка Нобелевских премий.
О практической значимости каталитических процессов свидетельствует тот факт, что на долю азота, входящего в состав полученных промышленным путем азотсодержащих соединений, приходится около половины всего азота, входящего в состав пищевых продуктов. Количество соединений азота, образующихся естественным путем, ограничено, так что производство пищевого белка зависит от количества азота, вносимого в почву с удобрениями. Невозможно было бы прокормить и половину человечества без синтетического аммиака, который получают почти исключительно с помощью каталитического процесса Габера – Боша.
Область применения катализаторов постоянно расширяется
Важно и то, что катализ позволяет значительно повысить эффективность ранее разработанных технологий. В качестве примера можно привести усовершенствование каталитического крекинга благодаря использованию цеолитов



























