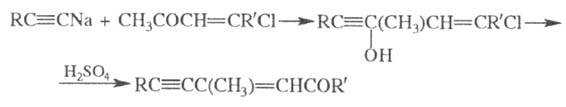Свойства алкинов
Физические свойства
По своим физическим свойствам алкины не сильно отличаются от алкенов и алканов. Например, простейший алкин, ацетилен, представляет собой газ без запаха и вкуса, мало растворимый в воде. Гомологи ацетилена включают как жидкие, так и твердые вещества: чем выше молекулярная масса, тем выше температуры кипения и плавления алкинов.
Химические свойства
Для алкинов, как и для алкенов, характерны реакции присоединения. Эти реакции протекают в две фазы:
Вопрос. Возможна ли реакция сложения для полученного соединения?
Поскольку полученный этилен содержит двойную связь, возможна вторая стадия этого процесса:
Вопрос. Возможна ли реакция сложения для полученного соединения? Почему?
Таким образом, и этилен, и этан могут быть получены из ацетилена с помощью реакции гидрирования. Все зависит от условий процесса и соотношения исходных материалов. Например, реакцию добавления хлористого водорода к ацетилену часто останавливают на первой стадии:
Причина в том, что хлорвинил используется для производства полимера полихлорвинила.
Задание 20.3: Составьте уравнения реакции полимеризации хлорвинила.
Продукты полихлорвинила (-CNCl-CH2–)nиспользуются различными способами.
Например, полихлорированный винил (ПХВ или ПВХ) является основой для искусственной кожи, различных одноразовых изделий, пластиковых контейнеров, футеровки, отделочных материалов и т.д. Многие пластиковые изделия, которыми мы пользуемся каждый день — обивка автомобилей, вагонов, самолетов — сделаны из ПВХ. Он также используется для изоляции кабелей.
Аналогичным образом происходят и другие реакции адгезии. Например, ацетилен, как и этилен, обесцвечивает бромированную воду. Он также обесцвечивает раствор перманганата калия, т.е. участвует в реакциях окисления.
Задание 20.4: Составьте уравнения для реакции ацетилена с бромом.
Таким образом, ацетилен также приводит к качественным реакциям в p-связи. Поэтому правильнее сказать, что реакции отбеливания воды бромом и перманганатом калия являются качественными реакциями по кратной связи. Другими словами, эти реакции могут быть использованы для обнаружения ненасыщенных соединений с кратной связью, содержащей p-связь.
Большое практическое значение имеет реакция добавления воды к ацетилену — гидратация ацетилена. Поскольку эта реакция была открыта и изучена русским ученым М.Г. Кучеровым*, ее называют «реакцией Кучерова»:
Ацетат альдегида используется для получения уксусной кислоты. Ожоги ацетиленом.
Задание 20.5: Напишите уравнение реакции горения ацетилена.
Газообразные углеводороды различают по типу пламени. Так, метан горит бесцветным пламенем, этилен — ярким пламенем, а ацетилен — дымным пламенем, т.е. углерод окисляется не полностью и частично выделяется в виде простого вещества (сажи). В потоке кислорода ацетилен горит ослепительным синим пламенем и выделяет большое количество тепла (температура пламени составляет более 3000 °C!). По этой причине данная реакция используется при газовой сварке и резке металлов.
Ацетилен-алленовая перегруппировка и миграция тройной связи
Перегруппировка алкинов в аллены и миграция тройной связи в углеродной цепии была открыта А. Е. Фаворским в 1888 г.
Промежуточной стадией данной реакции является образование аллена.
В ходе изомеризации терминальных алкинов в аллены и далее в нетерминальные алкины реализуется несколько последовательных стадий отщепления и переноса протона. Анионы, возникающие в результате депротонирования терминального алкина и аллена, являются типичными мезомерными анионами, в которых заряд делокализован между первым и третьим атомами углерода. Протонирование этих мезомерных анионов спиртом приводит к образованию алкина или аллена:
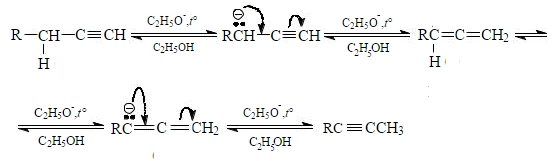
При этом следует обратить внимание, что все стадии ацетилен-алленовой перегруппировки обратимы. Поскольку терминальные алкины и аллены менее стабильны, чем нетерминальные, в равновесных условиях в результате перегруппировки образуется нетерминальный алкин
Поскольку терминальные алкины и аллены менее стабильны, чем нетерминальные, в равновесных условиях в результате перегруппировки образуется нетерминальный алкин.
История открытия
В 1836 году Эдмунд, двоюродный брат английского химика Хамфри Дэви, получил первый ацетилен.
Для этого он нагрел уголь вместе с ацетатом калия, добавил в раствор воду. В результате образовался карбид калия. Дэви назвал полученный газ бикарбонатом водорода.

Второй раз вещество получил немецкий врач Велер в 1862 году. Он воздействовал на карбид калия водой, получив ацетилен. Год спустя французский химик Бертло провел ряд других экспериментов. Он пропустил водород на графитовые электроды, которые предварительно нагрел электрической дугой. Он назвал образующийся газ ацетиленом. Это слово состоит из двух корней латинского и греческого языков, в переводе означает уксусное дерево. А в русском название появилось благодаря Дмитрию Менделееву.
В конце девятнадцатого века Фаворский начал изучение непредельных углеводородов, а в 1895 году Ле Шателье обнаружил интересное свойство, которым они обладают. Ацетилен при сгорании в кислороде дает горячее пламя, из-за чего позже его использовали при сварке и резке металлов. Согласно номенклатуре названия веществ образуются как производные от алканов путем замены суффикса.
Самый простой непредельный углеводород — этан, он превращается в этан. Гомологический ряд алкинов включает:

- конец — C10H18;
- нонин — C9H16;
- октин — C8H14;
- гептин — C7H12;
- гексин — C6H10;
- пентентин — C5H8;
- бутино — C4H6;
- пропин — C3H4;
- ацетилен — C2H2.
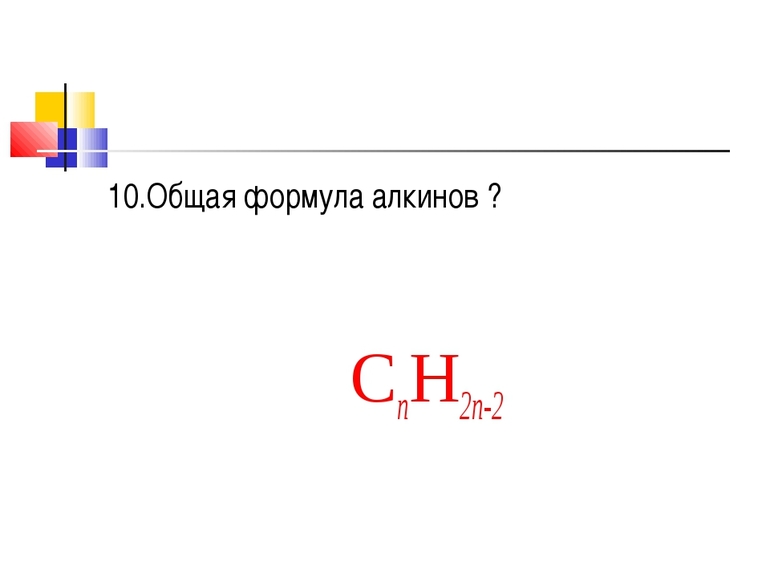
Весь структурный ряд алкинов имеет общую формулу — C (n) H (2 n — n).
https://youtube.com/watch?v=ow7mjjUx7Z4
Физические свойства
Алкин обладает определенными физическими свойствами. Они могут находиться в разных агрегатных состояниях:

- от С2 до С4 — газ;
- С5-С16 — жидкости;
- над C17 — твердые углеводороды.
Вещества кипят при температурах намного более высоких, чем те, которые необходимы для нагрева других производных. Растворимость в воде очень низкая, хотя и выше, чем у алканов и алкенов. Но в неполярных органических жидкостях алкины легко расщепляются на атомы.
Сначала необходимо прокалить смесь кокса с оксидом кальция в электропечи, постоянно поддерживая температуру 1800-2000 градусов. В результате образуется карбид кальция, который реагирует с водой с образованием ацетилена и гидроксида.
Алкины можно получить, пропуская природный газ с кислородом через огнеупорную упаковку. Он выгорает, температура воздуха повышается и приводит к пиролизу метана. Крекинг делится на два метода: электрический и термоокислительный. В первом метан пропускается через два металлических электрода с большой скоростью при температуре 1500 градусов. А при втором способе газ выгорает, одновременно окисляясь.
В лабораторных условиях ацетилен извлекается прямым синтезом. Это исторический метод, который использовал Бертло в 1863 году. Он нагрел водород с углеродом до высокой температуры. Кекуле в 1864 году получил вещество электролизом малеата натрия и фумарата. И вы также можете дать ему реакцию дегидрогалогенирования, и лучше использовать амид натрия-аммония в качестве галогеналканового агента. В лабораториях ученые алкилируют ацетилен, а также используют группы Кучерова, Кори-Фукса, Фрича-Буттенберга-Вичелла.
https://youtube.com/watch?v=Lh6DcIfCWVk
Применение углеводородов
Из всех непредельных углеводородов наибольшее применение имеет ацетилен. Используется как один из основных видов химического сырья. Вещество используется для синтеза нескольких видов продуктов:

- растворители;
- пластификаторы;
- шины;
- полимеры.
Хлорирование ацетилена дает дихлорэтилен, тетрахлорэтан и трихлорэтилен, которые используются как сильные растворители. Акрилонитрил образуется в результате изомерии вещества с цианистым водородом, таким образом образуется полиакрилонитрил. Полиакриламид можно получить конденсацией ацетилена с аммиаком и диоксидом углерода. Сырьем для уретановых полимеров является тетрагидрофуран.
Поливинилхлорид получают гидрохлорированием вещества, а уксусная кислота превращает его в характерный поливинилацетат. Класс альдегидов образуется при гидратации ацетилена, что позволяет получать ацетон, уксусную кислоту и другие продукты. Синтез полимеров осуществляется с использованием винилацетилена, результата димеризации вещества. Каучуки содержат хлоропрен и бутадиен.
https://youtube.com/watch?v=YcjPieRycxk
Ацетилен при горении выделяет тепло, его используют для сварки и резки тугоплавких металлов. В начале прошлого века использовались лампы, сырьем для которых служил карбид кальция — недорогое вещество. Их можно было увидеть на вечерних улицах, в домах, в морском и железнодорожном транспорте. Сегодня они используются туристами в качестве кемпингового снаряжения, хотя и производятся в небольших количествах.
Получение алкинов
Метановый способ. Основным промышленным способом получения ацетилена является пиролиз метана и его ближайших гомологов. В качестве сырья используется природный газ. В 1868 г. французский химик М. Бертло получил ацетилен, пропуская через метан электрический разряд:
При температуре 1500 °С ацетилен является промежуточным продуктом разложения метана до углерода и водорода, поэтому основной технологический приём процесса заключается в быстром выводе ацетилена из сферы реакции и его охлаждении.
Одним из вариантов метанового метода синтеза ацетилена является окислительный пиролиз природного газа (рис. 22). Особенность этого метода состоит в том,
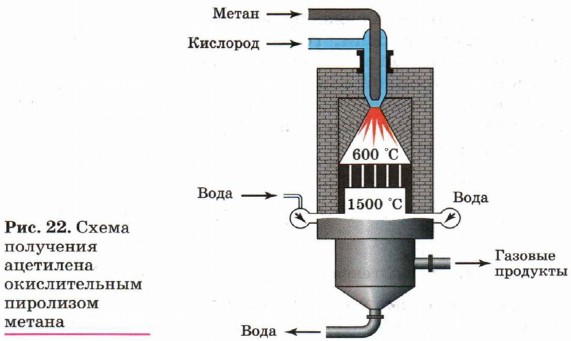
что в реактор вводится расчётное количество кислорода:
![]()
Помимо ацетилена в качестве продуктов реакции образуется оксид углерода (II) и водород, которые могут быть использованы для синтеза спиртов или синтетического бензина.
Карбидный способ. Давно известным и достаточно удобным способом получения этина является гидролиз (обменное взаимодействие веществ с водой) некоторых карбидов, например карбида кальция:
Карбид кальция получают взаимодействием оксида кальция, образовавшегося при обжиге (термическом разложении) карбоната кальция, с углем:
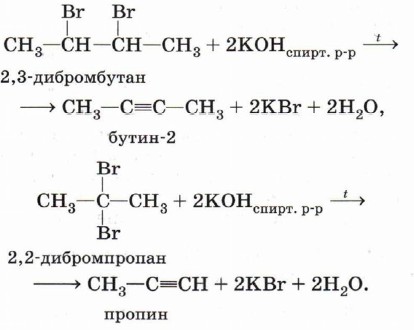
Дегидрогалогенирование. При воздействии на дибромпроизводное, в котором атомы галогенов находятся при соседних атомах углерода (или при одном и том же атоме), спиртового раствора щёлочи происходит отщепление двух молекул галогеноводорода (дегидрогалогенирование) и образование тройной связи:
Взаимодействия с веществами
Изомеры реагируют с другими веществами. Они взаимодействуют с разными солями и щелочами:

- альдегиды;
- кетоны;
- соли тяжелых металлов;
- щелочноземельные реагенты;
- металлический натрий.
Качественная реакция с солями тяжелых металлов приводит к появлению нерастворимых осадков ацетиленидов. Монозамещенные гомологи взаимодействуют с оксидами меди и хемихлоридом серебра. Первое вещество белое или бесцветное, второе — красное или желто-коричневое. Ацетилениды могут взорваться; под действием кислот они разлагаются на соли металлов и ацетилен.

Гомологи реагируют со щелочными металлами, которые получают из жидкого аммиака. Производные натрия действуют по правилам реактива Йоцича или Ревьярда, поэтому часто используются в органическом синтезе. Под легким давлением вещество взаимодействует с едким калием и кетонами, такую реакцию изучал Фаворский.
И если он изначально занимает это положение, то при реакции со спиртово-щелочным раствором переместится в центр молекулы.
https://youtube.com/watch?v=TyDZoBV02Mg
Реакции замещения водородных атомов ацетилена
Алкины с концевой тройной связью, то есть алкины-1, могут проявлять слабые кислотные свойства. Значительная подвижность атомов водорода, которые обладают связями с sp-гибридизированными атомами углерода в молекулах алкинов, объясняется процессом поляризации σ-связи \equiv С─Н. В результате атомы водорода замещаются атомами металлов. Итогом такого преобразования является образование солей — ацетиленидов.
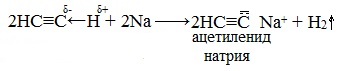
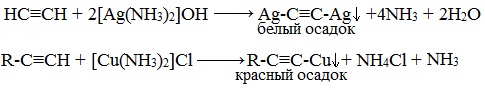
Из ацетиленидов металлов щелочного и щелочноземельного типа получают гомологи ацетилена. Если ацетилен пропустить через аммиачный раствор оксида серебра или хлорида меди, то в результате произойдет образование и выпадение в осадок ацетиленидов серебра и меди.
Примечание
Осадок металлов образуется в результате качественной реакции на концевую тройную связь. При этом для осадка ацетиленида серебра характерен серо-белый оттенок, а осадок ацетиленида меди обладает красно-коричневым цветом.
В процессе воздействия хлороводородной кислоты на ацетилениды серебра и меди можно наблюдать достаточно простое разложение солей очень слабых кислот, при котором выделяется исходный алкин.
![]()
Вещества отличаются по некоторым химическим свойствам. К примеру, ацетилиниды серебра и меди, находящиеся в сухом виде, могут взрываться под действием значительных механических нагрузок. Карбит кальция, который относится к группе ацетиленидов, при ударе достаточно устойчив. Данное вещество активно используется для получения ацетилена. Следует учитывать, что в случае, когда тройная связь не находится на конце цепи, то кислотные свойства в этом случае будут отсутствовать. Если нет подвижного атома водорода, то образование ацетиленидов невозможно.
Циклоолигомеризация алкинов
Определение 1
Олигомеризация – процесс, приводящий к образованию олигомеров, т.е. органических соединений с небольшой длиной углеводородного скелета.
Таким образом, олигомеры занимают промежуточное положение между мономерами и полимерами. На примере ацетилена процесс олигомеризации выглядит следующим образом:
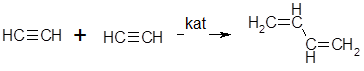
В данном случае получается бутадиен-1,3 (дивинил), который является сырьем для получения бутадиенового каучука.
Соответственно, циклоолигомеризация – это процесс получения циклических олигомеров. Данный процесс особенно характерен для алкинов. В результате получаются ароматические соединения:

Использование катализатора значительно снижает температуру проведения реакции:

В результате данной реакции получается циклогексатриен (бензол) – простейший ароматический углеводород, широко используемый в промышленности для производства лекарств, пластмасс, синтетической резины, красителей.
Известна также реакция олигомеризации с образованием восьмичленного ароматического соединения – циклооксатетраена:
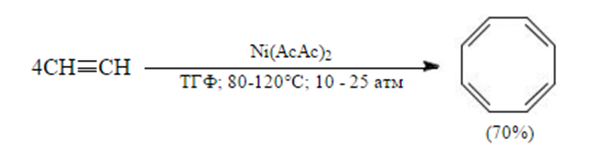
Строение молекул
В состав молекулы любого алкина входит тройная связь, поэтому характеристики свойств этих соединений будут связаны с характеристиками тройной связи. Это сложные и разнородные отношения. Он состоит из простой облигации и двух облигаций.
Запрос. Какая из этих связей легче всего разрывается в химических реакциях? Почему?
Это означает, что, как и в случае с алкенами, в химических реакциях в первую очередь разрушается самая слабая связь. Алкины также легко вступают в химические реакции, но в отличие от алкенов большинство реакций связывания протекает в два этапа: сначала разрывается одна связь, затем — вторая. Реакции присоединения являются типичной реакцией, хотя возможны и другие типы реакций.

Строение алкинов

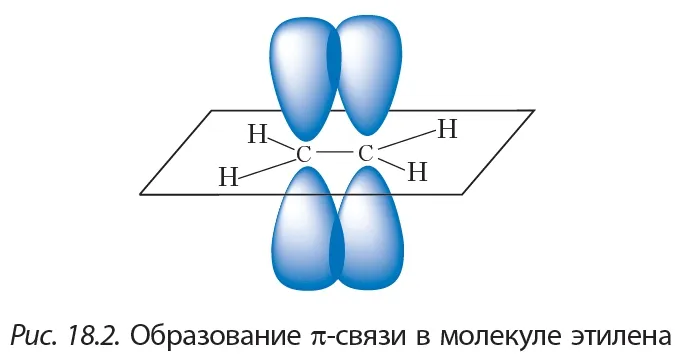
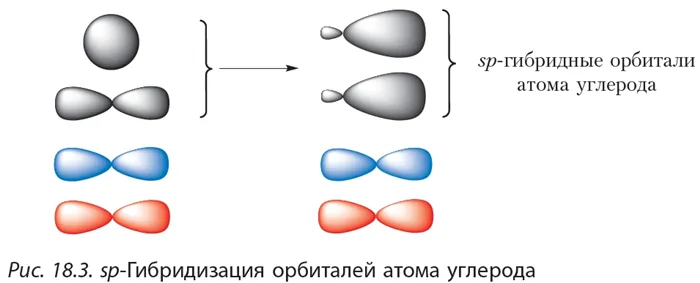
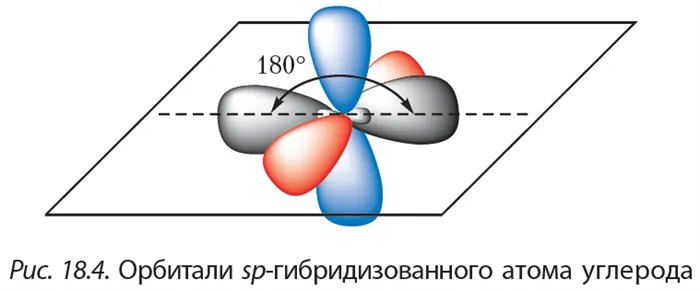
Орбитали атомов углерода, между которыми образована тройная связь (рис. 21), находятся в состоянии sp-гибридизации. Это означает, что в гибридизации участвует одна s- и одна р-орбиталь, а две р-орбитали остаются негибридизованными. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счёт негибридизованных р-орбиталей соседних атомов
углерода образуются две π-связи. Таким образом, тройная связь состоит из одной σ— и двух тс-связей. Все гибридные орбитали атомов, между которыми образована тройная связь, а также заместители при них (в случае этина — атомы водорода) лежат на одной прямой, а плоскости π-связей перпендикулярны друг другу (см. рис. 6, б).
Тройная углерод-углеродная связь, длина которой 0,12 нм, короче двойной. Энергия тройной связи больше, т. е. она является более прочной.
Получение и применение ацетилена
Ацетилен в небольших количествах входит в состав природных газов. Он образуется при разложении метана:
В небольших количествах, например, для сварки металлов и в лабораторных условиях, его получают из карбида кальция:

Ацетилен, получаемый карбидным методом, используется для сварки и резки металлов, поскольку температура пламени автогенного газа (сгорание ацетилена в кислороде) достигает 3000°C.
Ацетилен и его производные используются в производстве пластмасс, резины, уксусной кислоты и растворителей.

Атомы водорода в ацетилене могут быть замещены металлами (реакция минерализации). В результате образуются металлические производные ацетилена — ацетилены. Эту способность ацетилена можно объяснить следующим образом. Известно, что атомы углерода ацетилена, находящиеся в состоянии гибридизации sp, обладают повышенной электроотрицательностью (по сравнению с углеродами в других гибридных состояниях). Это немного смещает электронную плотность связи C-H в сторону углерода и придает атому водорода некоторую подвижность:
Образуются нерастворимые соли — ацетилениды. Это возможно только для алкинов, содержащих этинильную групп у-C=CH (так называемые терминальные алкины).
HC ≡ CH + 2CuCl → Cu — C ≡ C — Cu↓ + HCl
Этин → ацетилен двухвалентной меди(I)
CH3— C ≡ CH + CuCl → CH3— C ≡ C- Cu↓ + HCl
Пропен → метилацетилен Медь(I)
Образование темно-красного осадка ацетиленидов меди является качественной реакцией на этинильную группу, позволяющей отличить терминальные алкины от других ненасыщенных углеводородов.

С ацетиленидами в сухом виде следует обращаться очень осторожно: Они очень взрывоопасны
Реакции электрофильного присоединения
Галогенирование алкинов происходит в два этапа. Во время первой стадии электрофильного присоединения галогенов формируются дигалогеналкены. На втором этапе образуются тетрагалогеналканы. Схематично данные процессы представлены на рисунке.

Примечание
При реакции алкинов на бромную воду можно наблюдать качественную реакцию на алкины. В результате бромная вода теряет цвет.
Гидрогалогенирование происходит в соответствии с электрофильным механизмом. В процессе к алкинам присоединяются галогеноводороды. Реакция характеризуется двумя стадиями. Второй этап подчиняется правилу Марковникова. Присоединение НCl при отсутствии катализирующего компонента протекает с медленной скоростью. В качестве катализатора такой реакции используются кислоты Льюиса, то есть соли меди (I) и ртути (II).

В результате химической реакции получается хлористый винил или винилхлорид. Вещество характеризуется легкостью полимеризации, аналогично этилену, после чего образуется полимер, называемый поливинилхлоридом. Вещество обладает широкими сферами применения для изготовления поливинилхлоридных смол.
Химические свойства алкинов.
Химические свойства алкинов объясняются наличием тройной связи в молекуле алкиния. Типичной реакцией для алкинов является реакция присоединения, которая протекает в 2 этапа. На первом этапе происходит присоединение и образование двойной связи, а на втором этапе — присоединение к двойной связи. Реакция алкинов протекает медленнее, чем алкенов, потому что электронная плотность тройной связи более компактна, чем у алкенов, и поэтому менее доступна для реагентов.
1. галогенирование. Галогены присоединяются к алкинам в два этапа. Например,
Алкины также обесцвечивают бром как алкены, поэтому эта реакция также качественна для алкинов.
2. гидрогалогенирование. Галогенированные углеводороды связываются с тройной связью несколько труднее, чем с двойной. Для ускорения этого процесса используется сильная кислота Льюиса AlCl.3. В этих условиях из ацетилена можно получить винилхлорид, который используется для получения полимера поливинилхлорида, имеющего наибольшее промышленное значение:
Если галогеноводород присутствует в избытке, реакция (особенно с асимметричными алкинами) протекает по правилу Марковникова:

3. гидратация (добавление воды). Реакция протекает только в присутствии солей ртути(II) в качестве катализатора:
На этапе 1 образуется ненасыщенный спирт, в котором гидроксильная группа расположена у атома углерода, образующего двойную связь. Эти спирты называются виниловыми спиртами или фенолами.
Характерной особенностью этих спиртов является их нестабильность. Они изомеризуются в более стабильные карбонильные соединения (альдегиды и кетоны) путем переноса протонов от группы OH к углероду двойной связи. В этом случае π-связь (между атомами углерода) разрывается и образуется новая π-связь между атомами углерода и атомом кислорода. Эта изомеризация происходит из-за более высокой плотности двойной связи C=O по сравнению с двойной связью C=C.
Только ацетилен превращается в альдегиды, в то время как его гомологи превращаются в кетоны. Реакция следует правилу Марковникова:
Эта реакция называется реакцией Кучерова.
4. алкины, которые имеют терминальную тройную связь, могут отщеплять протон под действием сильных кислотных реагентов. Такой процесс обусловлен сильной поляризацией связи.
Эта поляризация вызвана сильной электроотрицательностью атома углерода при sp-гидрировании, поэтому алкины могут образовывать соли — ацетилениды:
Ацетиленоиды меди и серебра легко образуются и выпадают в осадок (при пропускании ацетилена через раствор оксида серебра-аммиака или хлорида меди-аммиака). Эти реакции являются качественными для тройной связи на конце:
Тримеризация алкинов
При пропускании этина над активированным углем образуется смесь продуктов, одним из которых является бензол:
Впервые подобную реакцию в 1866 г. осуществил М. Бертло. При нагревании ацетилена до 600 °С ему удалось получить небольшое количество бензола. Спустя 60 лет русский химик Н. Д. Зелинский (1861—1953) обнаружил, что катализатором данной реакции является углерод (активированный уголь). Даже при более низкой температуре в присутствии активированного угля скорость реакции значительно возрастала, а выход бензола увеличивался до 90%. С тех пор эта реакция носит имя Зелинского.
Реакции присоединения
Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электрофильного присоединения.
Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома):
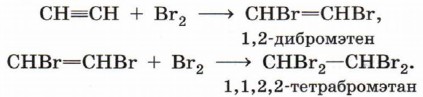
Гидрогалогенирование (присоединение галогеноводорода). Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идёт в две стадии, причём на обеих стадиях выполняется правило Марковникова:

Рассмотрим, почему бромоводород присоединяется к алкинам в соответствии с правилом Марковникова.
Предпочтительное присоединение катиона водорода (электрофильной частицы) к более гидрированному атому углерода определяется большей устойчивостью катиона , стабилизированного положительным индуктивным эффектом метильной группы (см. § 9), по сравнению с карбокатионом , в котором донорное влияние метильнои группы на углерод с положительным зарядом ослаблено.
Чтобы определить направление присоединения второй молекулы бромоводорода, сравним устойчивость следующих карбокатионов:

Частица (а) оказывается более устойчивой, так как она стабилизируется двумя положительными индуктивными эффектами метильных групп. Кроме того, атом брома обладает положительным мезомерным эффектом (орбиталь с неподелённой электронной парой брома перекрывается с незаполненной орбиталью атома углерода), который может проявиться только в том случае, если атом брома присоединён непосредственно к атому углерода, обладающему незаполненной орбиталью, т. е. несущему положительный заряд:
Гидратация (присоединение воды). Большое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:

Вода присоединяется к ацетилену в присутствии солей ртути (II) в кислой среде с образованием непредельного спирта — енола:
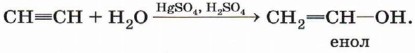
Получившийся енол немедленно превращается в альдегид:
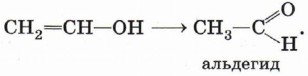
Явление взаимопревращения енолов и альдегидов (енолов и кетонов) называется кето-енольной таутомерией и будет более подробно рассмотрено в § 19 «Альдегиды и кетоны».
Альдегид образуется только при гидратации этина. В случае алкинов с более длинной цепью в соответствии с правилом Марковникова будет происходить образование енола с гидроксигруппой при менее гидрированном атоме углерода (водород присоединяется к крайнему атому углеродной цепи). Такие енолы превращаются в кетоны:

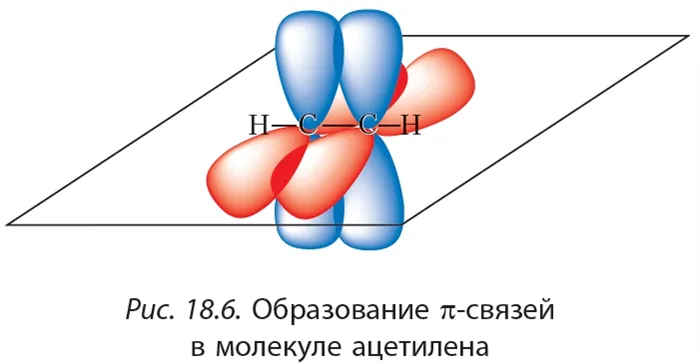
Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов (Pt, Pd, Ni):

Так как тройная связь содержит две реакционноспособные π-связи, алкины присоединяют водород в две ступени.
Этинилирование карбонильных соединений
Этинилирование (ацетиленирование) – это процесс, приводящий к введению этинильной группы $-C≡CH$ в молекулу органического соединения.
Этинилирующими агентами служат ацетилен и его монозамещенные производные. Наиболее распространено этинилирование карбонильных соединений (альдегидов или кетонов):

Данная реакция проводится в присутствии ацетиленидов металлов ($Hg$, $Ag$, $Au$ и других) (реакция Реппе) либо в присутствии твердого $KOH$ при температуре -70 — 40°С и приводит к образованию ацетиленовых спиртов:
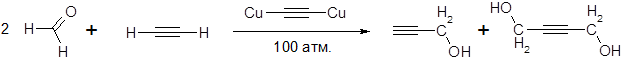
Также в качестве этинилирующего агента используются ацетилениды щелочных металлов в жидком аммиаке с последующим гидролизом. В качестве примера можно привести этинилирование хлорвинилметилкетона ацетиленидом натрия с последующей перегруппировкой в ениновый кетон – сырье для синтеза витамина А (реакция Джонса-Уидона):